
【题目】国际元素相对原子质量表上查得C是12.01,这是碳的( )
A.质量数B.原子质量
C.元素的平均相对原子质量D.同位素相对原子质量
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 120克NaHSO4固体含有离子数目为3NA
B. 总质量为1g的O2与N2混合气体含有的电子数为0.5NA
C. Na2O2与CO2反应时,每产生1 mol O2转移电子数为NA
D. 向含有FeI2的溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O (未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O (未配平)
(1)下列关于反应①的说法中错误的是_________(选填编号)。
a.被氧化的元素是Cu和S b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S d.每生成2.24 L(标况) SO2,转移0.6mol电子
(2)配平并标出反应②中电子转移的方向和数目:_____
MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O
(3)若将H2O2加入KMnO4有反应:2KMnO4+7H2O2+3H2SO4= K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是_________mol。
II.已知在碱性条件下:MnO4-+e-—→MnO42- (绿色)
(4) 将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,并且有气泡生成,写出反应的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe+3Br2═2FeBr3 , Fe2+的还原性大于Br﹣ . 现有16.8g铁和0.3mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2 . 下列叙述不正确的是( )
A.当a=0.1时,发生的反应为2Fe2++Cl2═2Fe3++2Cl﹣
B.当a=0.45时,发生的反应为2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣
C.若溶液中Br﹣有一半被氧化时,c(Fe3+):c(Br﹣):c(Cl﹣)=1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl﹣)+c(Br﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2﹣溴丙烷为主要原料制取1,2﹣丙二醇时,需要经历的反应依次是( )
A.加成→消去→取代
B.消去→加成→取代
C.取代→消去→加成
D.取代→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气的主要污染物为硫的氧化物和氮的氧化物。研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:

各室中发生的反应如下:
氧化室:NO2+SO2+H2O==H2SO4+NO
清除室:NO+NO2==N2O3、N2O3+2H2SO4==2NOHSO4(固体)+H2O
分解室:4NOHSO4(固体)+O2+2H2O==4H2SO4+4NO2
(1)物质①和②分别为(填化学式)________、__________。
(2)写出SO2、O2与H2O反应生成H2SO4的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第________族。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,利用电解所得气体制36.5%的浓盐酸1000 t,最少需要消耗食盐________t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
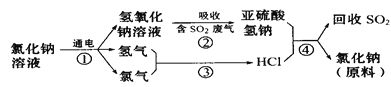
写出②④的化学反应方程式______________________________、 _________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有________。
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com