
����Ŀ�����й��ڳ����л����˵������ȷ���ǣ� ��
![]() ������˿�;���ϩ����Ҫ�ɷֶ�����ά��
������˿�;���ϩ����Ҫ�ɷֶ�����ά��
![]() ���顢�Ҵ���������һ�������¶��ܷ���ȡ����Ӧ
���顢�Ҵ���������һ�������¶��ܷ���ȡ����Ӧ
![]() �����������顢��ϩ�������ȼ�գ��������������ɶൽ��
�����������顢��ϩ�������ȼ�գ��������������ɶൽ��
![]() ��ȥ���������в��������ᣬ�ӹ�������Na2CO3��Һ���÷�Һ
��ȥ���������в��������ᣬ�ӹ�������Na2CO3��Һ���÷�Һ
![]() �������к���̼̼˫���͵��������ܷ����ӳɷ�Ӧ��Ҳ�ܷ���ȡ����Ӧ
�������к���̼̼˫���͵��������ܷ����ӳɷ�Ӧ��Ҳ�ܷ���ȡ����Ӧ
![]() ʯ�ͷ����ú�ĸ������������仯��ʯ�͵��ѻ����ѽⶼ���ڻ�ѧ�仯
ʯ�ͷ����ú�ĸ������������仯��ʯ�͵��ѻ����ѽⶼ���ڻ�ѧ�仯
A.�٢ݢ�B.�ڢۢ�C.�٢ڢ�D.�ڢܢ�
���𰸡�B
��������
��������Ҫ�ɷֶ�����ά�أ���˿����Ҫ�ɷֶ��ǵ����ʣ�����ϩ����Ҫ�ɷ��Ǻϳ����ϣ��ʢٴ���
�ڼ������������շ�Ӧ������һ�ȼ��飻�������������Ҵ������ᷴӦ�������������������Լ��顢�Ҵ���������һ�������¶��ܷ���ȡ����Ӧ���ʢ���ȷ��
���л����к���Խ�࣬ȼ��ʱ��������������Խ�ʢ���ȷ��
���������������ڱ���̼���ƣ���������Ա�̼��ǿ������̼���Ʒ�Ӧ���ɶ�����̼�������գ�Ȼ���Һ�ɵõ������������������ʢ���ȷ��
�ݱ���������̼̼˫�����ǽ��ڵ�����˫������Ĺ��ۼ����ʢݴ���
��ú�ĸ�����ú�ڿ����м�ǿ�ȷ����ĸ��ӵĻ�ѧ��Ӧ�����ڻ�ѧ�仯���ʢ���
��ȷ�Ģڢۢ�
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��õζ�����ȡһ�������Ũ��ˮ������ƿ�У���NaOH��Һ�Ժ㶨�ٶ����ζ���Ũ��ˮ�����ݲⶨ������Ƴ�ClO����ClO3�������ӵ����ʵ���Ũ��c��ʱ��t�Ĺ�ϵ�������¡�����˵����ȷ����

A.NaOH��Һ��Ũ��ˮ����ʹ��ͬ�ֵζ���ʢװ
B.![]() ����Һ�д������¹�ϵ��c(Na+)+ c(H+)=c(ClO��) +c(ClO3��) +c(OH��)
����Һ�д������¹�ϵ��c(Na+)+ c(H+)=c(ClO��) +c(ClO3��) +c(OH��)
C.![]() ����Һ�и�����Ũ�ȣ�c(Na+)�� c(Cl��) ��c(ClO3��) =c(ClO��)�� c(OH��) ��c(H+)
����Һ�и�����Ũ�ȣ�c(Na+)�� c(Cl��) ��c(ClO3��) =c(ClO��)�� c(OH��) ��c(H+)
D.t2~t4��ClO�������ʵ����½���ԭ�������ClO�������绯��2 ClO��=Cl��+ClO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸�����ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
CH3OH(g)��H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
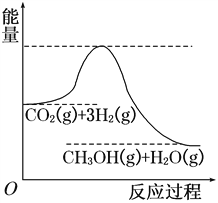
��1��������Ӧƽ�ⳣ��K�ı���ʽΪ________________���¶Ƚ��ͣ�ƽ�ⳣ��K________(��������������������������С��)��
��2�������Ϊ2 L���ܱ������У�����1 mol CO2��3 mol H2�����CO2�����ʵ�����ʱ��仯���±���ʾ���ӷ�Ӧ��ʼ��5 minĩ��������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)��________��
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
��3������������ʹ������Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________(��д�����ĸ)��
a����ʱ�����CH3OH����
b���ʵ������¶�
c�������������ݻ����䣬�ٳ���1 mol CO2��3 mol H2
d��ѡ���Ч����
������1�����ݻ�Ϊ2 L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬��ͼ��ʾ(T1��T2������300��)
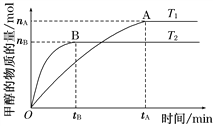
����˵����ȷ����________(�����)��
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)��![]() mol��L��1��min��1
mol��L��1��min��1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ![]() ����
����
��2����T1�¶�ʱ����1 mol CO2��3 mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊ�����������ڵ�ѹǿ����ʼѹǿ֮��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƿdz���Ҫ����Դ�ͻ���ԭ�ϣ���ش��������⡣
��1����CH4����ԭNOx�������������������Ⱦ�����磺CH4(g)+4NO2(g)��4NO(g)��CO2(g)+2H2O(g)����H����574 kJ��mol-1��CH4(g)+4NO(g)��2N2(g)��CO2(g)+2H2O(g)����H����1160 kJ��mol-1��д��CH4��ԭNO2��N2���Ȼ�ѧ����ʽ��_____��
��2������ͼ��ʾ��װ�â�Ϊ����ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ�â�ʵ��������ͭ��
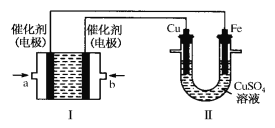
��a��Ӧͨ��______(����CH4������O2��)��a���缫�Ϸ����ĵ缫��Ӧʽ�� ___________��
�ڵ�ƽ�����װ�â���Cu2�������ʵ���Ũ��____(��д�����������С������������)��
����ʵ������Т��е�ͭƬ����������1.28g�����������������CH4�����(��״��)__ _L��
��3�������⣨2��װ�â��е����缫����Ϊʯī���Ե缫���������Һ��ΪCuSO4��Һ��
��д��װ�â��з������ܻ�ѧ��Ӧ����ʽ_________��
�ڵ������ͭ��Һһ��ʱ���װ�â�����Һ��pH____(��д�����������С������������)��Ҫʹԭ��Һ��ԭ������������Һ�м���_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ����(��˾ƥ��)��Ŀǰ����ҩ��֮һ��ʵ����ͨ��ˮ��������������Ʊ���˾ƥ�ֵ�һ�ַ������£�
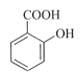 +(CH3CO)2O
+(CH3CO)2O![]()
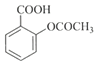 +CH3COOH
+CH3COOH
ˮ���� ���� ����ˮ����
ˮ���� | ������ | ����ˮ���� | |
�۵�/�� | 157~159 | -72~74 | 135~138 |
����ܶ�/(g/cm3) | 1.44 | 1.10 | 1.35 |
��Է������� | 138 | 102 | 180 |
ʵ����̣���100 mL��ƿ�м���ˮ����6.9 g��������10 mL�����ҡ��ʹ������ȫ�ܽ⡣�����μ�0.5 mLŨ�������ȣ�ά��ƿ���¶���70�����ң���ַ�Ӧ�������������²�����
���ڲ��Ͻ����½���Ӧ��Ļ���ﵹ��100 mL��ˮ�У��������壬���ˡ�
�����ýᾧ��Ʒ����50 mL����̼��������Һ���ܽ⡢���ˡ�
����Һ��Ũ�����ữ����ȴ�����˵ù��塣
�ܹ��徭�����ð�ɫ������ˮ���ᾧ��5.4 g��
�ش��������⣺
(1)�úϳɷ�Ӧ����ò���__________����(����)��
A. �ƾ��� B.��ˮԡ C.ú���� D.��¯
(2)���в��������У�������ʹ�õ���________(����)��
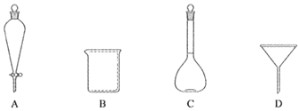
(3)������ʹ����ˮ��Ŀ����_________________________��
(4)���е���Ҫ��ѧ��Ӧ����ʽ�ǣ�____________________��
(5)�ܲ��õĴ�������Ϊ____________��
(6)��ʵ��IJ���Ϊ_________%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ�Ϊ2 L���ܱ������ڼ���0.2 mol ��N2��0.6 mol ��H2����һ�������·������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g) ��H��0,��Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��
2NH3(g) ��H��0,��Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��
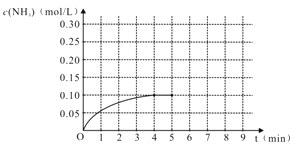
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)Ϊ_________________��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=___________________��
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ________��
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
��4����Ӧ�ﵽƽ���5����ĩ�����������������䣬��ֻ�������������Сһ�룬ƽ��_________________________�ƶ����������淴Ӧ����������������Ӧ��������������������ѧƽ�ⳣ��________________������������������С����������������
��5���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol/L����������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߡ�___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
��SO2��CS2��HI����ֱ���εķ��� �ڼ۵����Ų�ʽΪns2��ԭ�����ڢ�A���A��Ԫ�ء���Ge�Ǣ�A���һ��Ԫ�أ����������Ų�ʽΪ����Ar]4s24p2������P��Ԫ�ء��ܷǼ��Է��������Ǹ߶ȶԳƵķ��ӣ�����BF3��PCl5��H2O2��CO2�����ķ��Ӣݻ�����NH4Cl��CuSO4��5H2O��������λ������AgCl��һ�ְ�ɫ�ij��������������ᡢŨ���ᡢ�ռ���Һ��ȴ�����ڰ�ˮ�� ����֪����״̬��HgCl2���ܵ��磬HgCl2��ϡ��Һ�����ĵ��������ҿ���������������Һ����Ӳ�ͬ�Ƕȷ���HgCl2��һ�ֹ��ۻ�����ǵ���ʡ��Ρ����Ӿ��� �ఱˮ�д�NH3��H2O��������á�������ʾ����ϳ�NH3��H2O���ӣ����ݰ�ˮ�����ʿ�֪NH3��H2O�ĽṹʽΪ![]()
A.�٢�B.�ڢ�C.�ݢ�D.�ݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Deacon�������Ȼ���ֱ��ת��Ϊ������4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(g) ��H����ͼΪ�����ܱ������У�����Ũ�ȱ�c(HCl)��c(O2)�ֱ����1��1��4��1��7��1ʱ��HClƽ��ת�������¶ȱ仯�Ĺ�ϵ������˵����ȷ����
2Cl2(g)��2H2O(g) ��H����ͼΪ�����ܱ������У�����Ũ�ȱ�c(HCl)��c(O2)�ֱ����1��1��4��1��7��1ʱ��HClƽ��ת�������¶ȱ仯�Ĺ�ϵ������˵����ȷ����
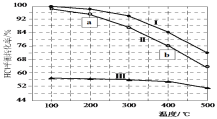
A.��H> 0
B.����Ӧ����v��(a)<v��(b)
C.���ߢ����Ũ�ȱ�c(HCl)��c(O2)����1:1
D.��HCl��ʼŨ��Ϊc0�������ߢ����K(400��)������ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�õ���������ȷ����
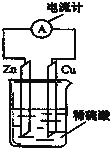
A.��װ�ù���ԭ��أ�п��ʧ������������Cu �������������ϵ缫��ӦʽΪ Zn-2e-=Zn2+������п����������
B.�����Ӹ���п�ص�����������ͭ
C.��װ���ǽ�����ת��Ϊ��ѧ�ܵ�װ�ã�Ϊԭ���
D.��������пƬ�ϱ���ԭ������пƬ������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com