
| △c |
| △t |
| 1 |
| 3 |
| 1 |
| 2 |
| ||
| 5s |
| 1mol |
| 2L |


科目:高中化学 来源: 题型:
| A、④③②① | B、①②③④ |
| C、③②④① | D、③④②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以把FeCl3固体直接溶于水制FeCl3溶液 |
| B、热的纯碱溶液去油污效果好 |
| C、加热AlCl3溶液可得到AlCl3固体 |
| D、Mg粉投入到饱和NH4Cl溶液中无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 |
| B、开启啤酒瓶时,有大量泡沫状气泡涌出瓶口 |
| C、工业合成氨气,采用铁触媒,并在500℃进行反应 |
| D、对于2HI(g)?H2(g)+I2(g);△H>0,升高温度可使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
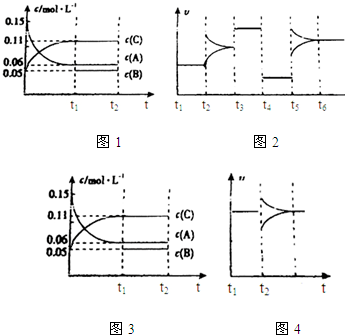
查看答案和解析>>
科目:高中化学 来源: 题型:
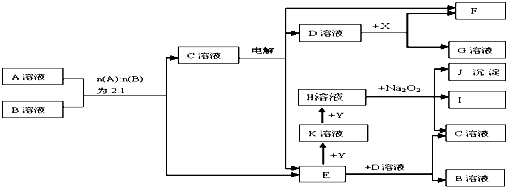
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com