
【题目】常温下,酸性溶液A中可能含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32-、NO3-、Cl-、I-、SO42-中的几种,现取该溶液进行有关实验,实验结果如下图所示:

回答下列问题:
(1)溶液A中一定存在的离子有___________________
(2)生成沉淀甲的离子方程式为___________________
(3)生成气体丙的离子方程式为__________________,若实验消耗Cu 144g,则最多生成气体丙的体积(标准状况下)为_____。
依据上述实验,某小组同学通过讨论后认为:溶液中可能含有的离子有NH4+、K+、Na+ 、Cl-、SO42-。为进一步确认溶液中存在的离子,分别取100ml废水又进行了如下图所示的三组实验:

(4)根据上述实验可进一步确定NH4+、K+、Na+ 、Cl-、SO42-中一定存在的离子有 _________ ,沉淀溶解时发生反应的离子方程式为________________________________。
【答案】 Al3+、NO3- 3H2O+2Al3++ 3CO32-=2Al(OH)3↓+3CO2 ↑ 3Cu+8H++NO3-═3Cu2++2NO↑+4H2O 33.6L NH4+、Na+ 、SO42- Al(OH)3+OH-=AlO2-+2H2O
【解析】(1)、溶液为酸性溶液,则溶液中存在大量氢离子,可以排除CO32;溶液A中加过量(NH4)2CO3,产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+,溶液一定含有有Al3+;溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,说明原溶液中有NO3,强酸性溶液中含有NO3,则一定不存在具有还原性的离子:Fe2+、I。故答案是Al3+、NO3-。
(2)、根据上述分析,生成沉淀甲是CO32-和溶液中的Al3+发生双水解反应,故离子方程式为3H2O+2Al3++ 3CO32-=2Al(OH)3↓+3CO2↑。
(3)、根据上述分析可知,生成的气体丙是NO,是Cu、H+和溶液中的NO3-反应生成的,离子方程式为3Cu+8H++NO3-═3Cu2++2NO↑+4H2O。
实验消耗Cu 144g,则Cu的物质的量是:144g÷64g/mol=2.25mol,由3Cu+8H++NO3-═3Cu2++2NO↑+4H2O可得:3Cu~2NO,则NO的物质的量是![]() ×2.25mol,其在标准状况下的体积是
×2.25mol,其在标准状况下的体积是![]() ×2.25mol×22.4L/mol=33.6L;故本题的答案是:3Cu+8H++NO3-═3Cu2++2NO↑+4H2O;33.6L。
×2.25mol×22.4L/mol=33.6L;故本题的答案是:3Cu+8H++NO3-═3Cu2++2NO↑+4H2O;33.6L。
(4)、因焰色反应为黄色,说明含有Na+;加入氯化钡和稀盐酸可以生成白色沉淀,说明溶液中一定含有SO42-,2.33g白色沉淀是BaSO4;根据上面的分析可知,溶液中含有H+和Al3+,根据图像可知,开始时发生的是H++OH-=H2O,当H+完全反应后,开始发生Al3++3OH-=Al(OH)3↓,继续滴加NaOH溶液,Al(OH)3并没有立刻溶解,说明溶液中含有NH4+,发生了NH4++OH-=NH3·H2O;故一定存在的离子还有:NH4+、Na+ 、SO42-;沉淀溶解时是Al(OH)3和过量的NaOH发生反应生成NaAlO2和H2O,其离子方程式是:Al(OH)3+OH-=AlO2-+2H2O。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )

A. 途径①的反应中体现了浓HNO3的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大O2的浓度来低成本
C. 由途径①、②、③分别制取1molH2SO4,理论上各消耗1molS,各转移6mole-
D. 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在水溶液中(或给定条件下)能大量共存的是
A. NH4+、Ba2+、Br-、CO32-
B. Na+、H+、NO3-、HCO3-
C. 在CuSO4溶液中:Na+、NH4+、NO3-、Mg2+
D. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 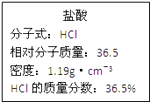
(1)该浓盐酸的物质的量浓度为mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配制250mL物质的量浓度为0.7mol/L的稀盐酸.
①该学生用量筒量取mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 .
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是(填字母).
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为mol/L.(填选项字母)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质或离子检验的判断正确的是( )
A.向溶液中滴加酚酞试液,溶液显红色:原溶液是NaOH
B.气体通过无水硫酸铜,粉末变蓝:原气体中含有水蒸气
C.灼烧白色粉末,火焰呈黄色:原粉末是钠盐
D.将气体通入澄清石灰水,溶液变浑浊:原气体是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列燃烧反应的反应热是燃烧热的是( )
A. H2(g)+![]() O2(g)===H2O(g)ΔH1 B. C(s)+O2(g)===CO(g)ΔH2
O2(g)===H2O(g)ΔH1 B. C(s)+O2(g)===CO(g)ΔH2
C. S(s)+O2(g)===SO2(g)ΔH3 D. H2S(g)+![]() O2(g)===S(s)+H2O(l)ΔH4
O2(g)===S(s)+H2O(l)ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是

A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为H2(g)+Cl2(g) ![]() 2HCl(g) ΔH=+183 kJ·mol-1
2HCl(g) ΔH=+183 kJ·mol-1
D.此反应的热化学方程式为1/2H2(g)+1/2Cl2(g) ![]() HCl(g) ΔH=-91.5 kJ·mol-1
HCl(g) ΔH=-91.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________。
(2)已知在25℃、101kPa下,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧热的热化学方程式_______________。
(3)标准状况下,4.48L H2在足量O2中完全燃烧放出热量Q kJ,写出H2燃烧的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、硫和钡元素是高中化学常见的元素,请运用相关性质回答下列问题:
(1)镁、钡是位于同一主族的活泼金属元素。钡在元素周期表中的位置是:_______。铝也是一种活泼金属,钡的金属性比铝的_______(填“强”或“弱”)。工业上可用如下方法制取钡:Al+BaO![]() Ba↑+BaO· Al2O3,该法制钡的主要原因是_________。BaO· Al2O3的物质种类是_______(填“酸、碱、盐或氧化物”等)。
Ba↑+BaO· Al2O3,该法制钡的主要原因是_________。BaO· Al2O3的物质种类是_______(填“酸、碱、盐或氧化物”等)。
(2) Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3固体配成溶液。
笫二步:加入适量H2SO4溶液和KI固体,滴加指示剂
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL
则c(Na2S2O3)=______mol/L。(已知:2S2O32-+I2=S4O62-+2I-)
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能_____(填“不受影响”、“偏低”或“偏高”),原因是 __________ (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com