
【题目】工业上常用电解法冶炼的金属是
A.FeB.AlC.CuD.Ag
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是( )
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称量8.75g食盐
C.用500mL的容量瓶配制480mL溶液
D.用广泛pH试纸测得某溶液的pH为3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反应的化学方程式为2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O。
(1)该反应中还原产物与氧化产物的物质的量之比为_________________。
(2)若该反应中有490克KClO3参加反应,则被氧化的HCl的质量为______________。
(3)若该反应产生2.24L(标准状况)ClO2,则转移的电子数目为_____________。
(4)某地生产的食盐氯化钠中含有少量的剧毒物质氰化钠(NaCN),用ClO2可除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒气体。写出该反应的化学方程式: ______________________。
(5)用双线桥法表示下列氧化还原反应的电子转移情况:____________________
2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】由羧酸A (C3H4O2) 经过如下合成路线获得药物中间体H。
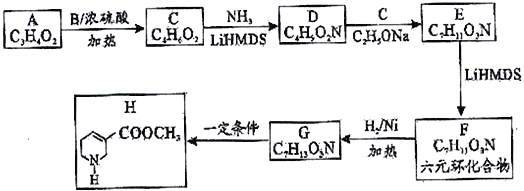
已知:Ⅰ.R1CH=CH1+RNH2 ![]() R1CH2CH2NHR(R可以是氢原子或烃基)
R1CH2CH2NHR(R可以是氢原子或烃基)
Ⅱ.R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
请回答:
(1)化合物A 的名称_________________,B的结构简式_______________。
(2)写出药物中间体H中两种官能团的名称_______________________。
(3)已知D的结构简式:H2N-CH2-CH2-COOCH3,D→E的反应类型________________,F→G的反应类型_________________。
(4)写出E→F的化学方程式______________________________________。
(5)写出化合物D符合下列条件的所有可能的同分异构体的结构简式_______(任写两种即可)
①分子中含六元环。
②红外光谱显示分子中含有碳氮单键。
③核磁共振氢谱显示分子中有3种化学环境不同的氢原子。
(6)设计由乙酸甲脂合成聚合物:![]() 的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和SO42-的离子个数比为( )
A.1∶2B.1∶4C.3∶4D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最终没有固体析出的是( )
A.向NaHCO3溶液中加入过量澄清石灰水
B.向饱和氢氧化钠溶液中加入钠单质
C.向氯化钡溶液中通入少量SO2
D.向饱和碳酸钠溶液中通入过量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A.分液漏斗使用前需要先检查是否漏液
B.试验中剩余的钠不能再放回原试剂瓶
C.做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D.蒸馏烧瓶加热时需要垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
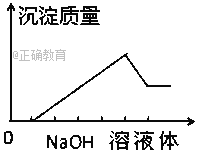
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是
A.用电解法精炼粗铜时,粗铜作阳极
B.在原电池中,铜电极只能作正极
C.在镀件上镀铜时,金属铜作阳极
D.锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com