
【题目】人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如图:

在阳极区发生的反应包括 和H ++ ![]()
![]() H2O + CO2↑。简述
H2O + CO2↑。简述![]() 在阴极区再生的原理 。
在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃,101 kPa下:H2(g) +![]() O2(g)
O2(g) ![]() H2O(g) Δ H1= 242 kJ/mol
H2O(g) Δ H1= 242 kJ/mol
CH3OH(g) +![]() O2(g)
O2(g) ![]() CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。

(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示,下列说法正确的是 。

A.p1> p2> p3>p4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1> T2> T3>T4
D.T4、p4时,H2的平衡转化率为60%
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。

【答案】(1)①4OH 4e![]() 2H2O + O2↑(或2H2O4e
2H2O + O2↑(或2H2O4e![]() 4H+ + O2↑) ②
4H+ + O2↑) ②![]() 存在电离平衡:
存在电离平衡:![]()
![]() H+ +
H+ +![]() ,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与
,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与![]() 反应,从而使
反应,从而使![]() 再生)
再生)
(2)①CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H = 50 kJ/mol ②a
CH3OH(g) + H2O(g) △H = 50 kJ/mol ②a
(3)ACD
(4)不变 CH3OH + H2O 6e![]() 6H++ CO2↑
6H++ CO2↑
【解析】本题考查电解池原理,热化学方程式的书写,化学平衡移动原理,原电池原理。
(1)在阳极区水电离产生的氢氧根离子放电生成氧气和氢离子,氢离子再与碳酸氢根离子结合生成二氧化碳气体和水,电极反应式为:①4OH 4e![]() 2H2O + O2↑(或2H2O4e
2H2O + O2↑(或2H2O4e![]() 4H+ + O2↑)②
4H+ + O2↑)②![]() 存在电离平衡:
存在电离平衡:![]()
![]() H+ +
H+ +![]() ,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与
,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与![]() 反应,从而使
反应,从而使![]() 再生)。
再生)。
(2)①H2(g) + 1/2 O2(g) ![]() H2O(g) Δ
H2O(g) Δ![]() CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol,3乘以第一个反应再减去第二个反应即得CO2和H2生成气态甲醇等产物的热化学方程式:CO2(g) + 3H2(g)
CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol,3乘以第一个反应再减去第二个反应即得CO2和H2生成气态甲醇等产物的热化学方程式:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H = 50 kJ/mol。②根据反应方程式,合成甲醇的反应是放热反应,反应物总能量大于生成物总能量,等物质的量的同种物质气态能量高于液态,故选a。
CH3OH(g) + H2O(g) △H = 50 kJ/mol。②根据反应方程式,合成甲醇的反应是放热反应,反应物总能量大于生成物总能量,等物质的量的同种物质气态能量高于液态,故选a。
(3) A.根据反应方程式,温度相同时压强增大,合成甲醇的反应正向移动,平衡时甲醇的物质的量分数增大,由图像知p1> p2> p3>p4,正确;B.化学方程式确定时平衡常数只与温度有关,甲醇的物质的量分数高,反应的平衡常数可能相等,错误;C.温度升高,平衡逆向移动,平衡时甲醇的物质的量分数减小,图示中,该反应的温度变化为:T1> T2> T3>T4,正确;D.T4、p4时甲醇物质的量分数为0.2,设甲醇物质的量为x。
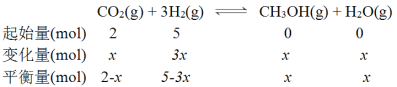
![]() ,x=1,H2的平衡转化率,3/5×100%=60%,正确,故选ACD。
,x=1,H2的平衡转化率,3/5×100%=60%,正确,故选ACD。
(4)B电极室是电池的正极,氧气得到电子与氢离子结合生成水,溶液体积变化忽略,所以工作结束后,B电极室溶液的pH与工作前不变;负极甲醇失去电子生成二氧化碳和氢离子,电极反应式为:CH3OH + H2O 6e![]() 6H++ CO2↑。
6H++ CO2↑。


科目:高中化学 来源: 题型:
【题目】(1)相同条件下,某容器共收集到1体积CO2、3体积H2,该容器中CO2、H2的物质的量之比是__________;若该容器收集的CO2、H2两种气体所含分子数相等,则CO2、H2的质量之比是_____________。
(2)0.01 mol某物质的质量为1.08g,此物质的摩尔质量为_________。
(3)已知A是二价金属,82 g该金属的硝酸盐中含有6.02 x1023个硝酸根离子,则该硝酸盐的摩尔质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4 B.铝、二氧化碳
C.硫酸、蔗糖 D.熔融KNO3、氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A. 自然界硅的贮量丰富
B. 自然界中存在大量单质硅
C. 二氧化硅被用于制作计算机芯片
D. 光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 MnO2 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水 CuCl2,装置如图所示。请回答下列问题:

(1)实验前检查整套装置的气密性的方法是______________,写出 A 中反应的化学方程式____________。
(2)B 中选用的试剂是____________,其作用是_____________;C 中选用的试剂是_____________,其作用是____________________。
(3)D 中反应的化学方程式是________________。
(4)装置 E 的目的是_______________,写出 E 中发生反应的化学方程式:______________。
(5)但实验发现 D 中得到的无水 CuCl2 总是偏蓝色,请你帮他们分析这是为什么?_________________,提出改进方案:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
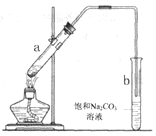
A. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
B. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
C. 试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“物质的量”是一个将微观粒子与宏观物质联系起来的物理量。下列说法不正确的是( )
A. 1 mol NaCl的体积为22.4 L
B. 1 mol H2含有6.02×1023个氢分子
C. 1 mol O2含有2 mol氧原子
D. 标准状况下,1 mol H2的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com