
【题目】下列说法正确的是
A.在任何条件下,1mol任何气体的体积都是22.4L
B.同温同压下,相同体积的两种气体物质,其物质的量一定相等
C.在相同温度下,气体分子间的平均距离几乎相等
D.测得1mol某气体的体积为22.4L,则测定条件一定是标准状况
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成生物体的元素,化合物及其作用,其中a、b、d、e、f代表小分子,A、B、E代表不同的生物大分子,请据图回答下列问题。

(1)物质a表示_______,其在原核细胞中共有______种。
(2)若E是动物细胞中特有的储能物质,则E是_______,其在人体中主要分布于______细胞。
(3)物质d是_____,物质f是_______,其在动植物细胞中均可含有,并且由于含能量多而且占体积小被生物作为长期储备能源的物质。
(4)物质b的名称是______,图中的“?”是指______元素。若某种B分子由n个b(平均相对分子质量为m)形成的两条链组成,则该B分子的相对分子质量大约为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠 杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓 CuSO4 溶液,一段时间后,下列 有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)

A. 杠杆为导体和绝缘体时,均为 A 端高 B 端低
B. 杠杆为导体和绝缘体时,均为 A 端低 B 端高
C. 当杠杆为绝缘体时,A 端低 B 端高;为导体时,A 端高 B 端低
D. 当杠杆为绝缘体时,A 端高 B 端低;为导体时,A 端低 B 端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
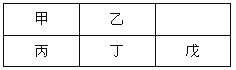
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学用语,有关说法不正确的是
①SO2②Fe3+③KMnO4④![]() ⑤
⑤![]()
A.①表示的是两种元素组成的化合物
B.②中数字的含义:一个铁离子带3个单位的正电荷
C.③中锰元素的化合价为+7价
D.④⑤表示的是同一种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主要用于高分子胶囊和印刷油墨的粘合剂的甲基两烯酸缩水油酯GMA(即:![]() )的合成路线如下(部分反应所需试剂和条件已略去):
)的合成路线如下(部分反应所需试剂和条件已略去):

已知:
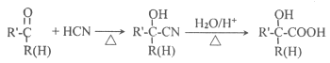
请按要求回答下列问题:
(1)GMA的分子式______________________;B中的官能团名称:______________________;甘油的系统命名:______________________。
(2)验证D中所含官能团各类的实验设计中,所需试剂有______________________。
(3)写出下列反应的化学方程式:反应⑤:____________________。反应⑧:______________________。
(4)M是H的同分异构体。M有多种同分异构体,写出满足下述所有条件的M的所有可能的结构:____________________________。
①能发生银镜反应 ②能使溴的四氯化碳溶液褪色 ③能在一定条件下水解
(5)已知: { 2 }![]()
![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯![]() Br
Br![]() ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为按树状分类法对一组物质进行的分类。回答下列问题。

(1)类别1为_________,类别2为____________。
(2)上述物质中属于电解质的是_______________。
(3)Ba(OH)2溶于水时的电离方程式为________________。向Ba(OH)2溶液中滴加稀硫酸,所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2熔点为-59.5℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某同学设计了如图装置来制取、收集ClO2并测定其质量。

实验I:制取并收集ClO2,装置如图所示。
(1)装置A除酒精灯外,还必须添加__________装置,目的是____________。装置B应该添加_____________(填“冰水浴”、“沸水浴”或“60℃的热水浴”)装置。
(2)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式_____________。
实验II:测定ClO2的质量,装置如图所示。过程如下:

①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加![]() 硫酸溶液;
硫酸溶液;
②按照如图组装好仪器:在玻璃液封管中加入水,浸没导管口;
③将生成的ClO2气体由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液;
④用cmol/L Na2S2O3标准液滴定锥形瓶中的液体,共用去VmL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是______________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m (ClO2)=_______![]() (用整理过的含
(用整理过的含![]() 的代数式表示)。
的代数式表示)。
(6)判断下列操作对m (ClO2)测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制Na2S2O3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出___________kJ 的热量。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com