
【题目】某学习小组欲制取氨气并探究其性质.请回答:
(1)实验室利用固体与固体反应制取氨气的化学方程式是 .
(2)①上图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 . ②氨气使烧杯中溶液由无色变为红色,其原因是(用方程式表示) .
(3)在上图的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是
A.HCl和H2O
B.NH3和H2O
C.NH3和苯
D.CO2和烧碱溶液.
【答案】
(1)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;NH3+H2O?NH3?H2O?NH4++OH﹣
(3)C
【解析】解:(1)氯化铵与氢氧化钙加热生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(2)①NH3极易溶解于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹K,由于氨气迅速溶解导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,故答案为:轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;②氨气与水反应生成一水合氨,一水合氨部分电离产生氢氧根离子和氨根离子,溶液显碱性,化学方程式:NH3+H2ONH3H2ONH4++OH﹣故答案为:NH3+H2ONH3H2ONH4++OH﹣;(3)A.氯化氢易溶于水,挤压胶头滴管,气体溶于水,体积减少,外压大于内压,形成喷泉,故A不选; B.氨气极易溶于水,则挤压胶头滴管,气体减少,外压大于内压,形成喷泉,故B不选; C.NH3和苯不反应,也不溶于水,不能形成压强差,不能形成喷泉,故C选; D.挤压胶头滴管,CO2和NaOH溶液,气体减少,外压大于内压,形成喷泉,故D不选;故选:C. (1)氯化铵与氢氧化钙加热生成氯化钙、氨气和水;(2)①氨气是极易溶于水的气体,使烧瓶内产生压强差导致溶液进入烧瓶;②氨气与水反应生成一水合氨,一水合氨部分电离产生氢氧根离子和氨根离子,溶液显碱性;(3)在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,若挤压胶头滴管,形成喷泉,则气体极易溶于水、或气体极易与溶液反应,以此来解答.
CaCl2+2NH3↑+2H2O;(2)①NH3极易溶解于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹K,由于氨气迅速溶解导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,故答案为:轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K;②氨气与水反应生成一水合氨,一水合氨部分电离产生氢氧根离子和氨根离子,溶液显碱性,化学方程式:NH3+H2ONH3H2ONH4++OH﹣故答案为:NH3+H2ONH3H2ONH4++OH﹣;(3)A.氯化氢易溶于水,挤压胶头滴管,气体溶于水,体积减少,外压大于内压,形成喷泉,故A不选; B.氨气极易溶于水,则挤压胶头滴管,气体减少,外压大于内压,形成喷泉,故B不选; C.NH3和苯不反应,也不溶于水,不能形成压强差,不能形成喷泉,故C选; D.挤压胶头滴管,CO2和NaOH溶液,气体减少,外压大于内压,形成喷泉,故D不选;故选:C. (1)氯化铵与氢氧化钙加热生成氯化钙、氨气和水;(2)①氨气是极易溶于水的气体,使烧瓶内产生压强差导致溶液进入烧瓶;②氨气与水反应生成一水合氨,一水合氨部分电离产生氢氧根离子和氨根离子,溶液显碱性;(3)在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,若挤压胶头滴管,形成喷泉,则气体极易溶于水、或气体极易与溶液反应,以此来解答.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84gcm﹣3的浓H2SO4来配制500mL0.25mol/L的稀H2SO4 . 可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号).
(2)经计算,需浓H2SO4的体积为 . 现有①10mL ②50mL ③100mL三种规格的量筒,应选用的量筒是(填代号).
(3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒 . 转移完毕,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处.改用加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中:能引起误差偏高的有(填代号).①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有漂白作用的物质有(1)氯气 (2)二氧化硫 (3)活性炭 (4)过氧化钠,其漂白原理相同的是
A. (1)(3)B. (2)(3)C. (1)(4)D. (2)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | CuO | Cu(OH)2 | CuSO4 | Cu | |
② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
A.①②③
B.①③④
C.②③④
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有①CH3COOH②HCl③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度最大的是________________(填序号)。
(2)当它们的物质的量浓度相同时,其pH最小的是____________(填序号)。
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_________。(填序号)
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为_____________;此时所得到的三种溶液的pH大小关系为_______________(填序号)。
(5)若酸性FeCl2溶液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 自然界中硫是一种淡黄色难溶于水的固体
B. 硫的化合物常存在于火山喷出的气体中和矿泉水里
C. 硫与金属反应,生成金属的低价态化合物
D. 硫在空气中的燃烧产物是二氧化硫,纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 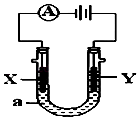
(1)若X,Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为 . 在X极附近观察到的现象是:
检验Y电极产物的方法是:
②电解总反应离子方程式为 .
(2)若X和Y仍均为惰性电极,a为CuSO 4 溶液,则电解时的化学反应方程式为
. 通过一段时间后,向所得溶液中加入16g CuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是
②Y电极的电极反应式是(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为醋酸,且a=4,那么A溶液中水电离出的氢离子浓度为________mol/ L。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性。则混合溶液中必定有一种离子能发生水解, 该离子为______________(填离子符号);
混合后的溶液中,下列微粒浓度大小关系一定正确的是___________(填序号)。
①c(MOH)>c(M+)>(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+) >c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
Ⅱ.难溶电解质的溶解平衡属于化学平衡的一种。
(1)已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈_______性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将________(填“增大”、“减小”或“不变”)。
Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈_______性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将________(填“增大”、“减小”或“不变”)。
(2)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:先加入FeSO4·7H2O与Cr2O72-反应生成Cr3+、Fe3+,然后调节pH,使之生成Cr(OH)3、Fe(OH)3。欲使10 L该废水中的Cr2O72-完全转化为Cr3+,则理论上需要加入_________g FeSO4·7H2O。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为_________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com