
| A、油脂是高级脂肪酸的甘油酯 |
| B、油脂与氢气发生加成反应,可以得到硬化油 |
| C、油脂在酸性条件或碱性条件下,可以发生皂化反应 |
| D、日常使用的花生油、豆油、动物油都是油脂,它们可以溶解一些脂溶性维生素 |


科目:高中化学 来源: 题型:
| A、5.6L |
| B、6.72L |
| C、1.344L |
| D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
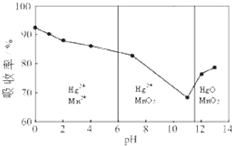 (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
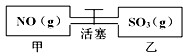 如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )
如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )| A、气体的密度 |
| B、气体分子数 |
| C、气体压强 |
| D、气体平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持恒容恒温条件,向密闭容器中充入氦气,化学反应速率将变快 |
| B、若容器的容积不变,降低温度,c(CO2)/c(CO)减小 |
| C、保持恒容恒温(T1)条件,8min达化学平衡状态时,v(CO)=0.0625mol/(L?s) |
| D、保持恒容恒温(T1)条件,8min后再加入足量FeO粉末并充入1.5mol的CO气体,重新达到平衡时,CO的转化率为33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
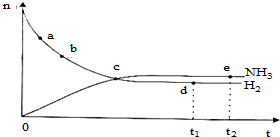 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、点c处用氨气的浓度表示的速率等于用氢气的浓度表示的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com