
【题目】(1)N2、CO2、SO2三种气体的物质的量比为1∶1∶1时,它们的分子个数比为___________;质量比为___________;同温、同压下体积之比为___________。
(2) 同温同压下,质量相同的四种气体: ① CO2 ② H2 ③ O2 ④ CH4
所占的体积由大到小的顺序是(填序号,下同)______ ______; 密度由大到小的顺序是__________。
(3) 22.2 g CaR2含R-0.4 mol,则CaR2的摩尔质量为___________,R的相对原子质量为___________。
(4) 将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为_________,氮原子和氧原子的个数比为___________,该混合气体的平均摩尔质量为______________。
【答案】
(1)1:1:1; 7:11:16; 1:1:1
(2)②④③① ①③④②
(3)111 g·mol-1 35.5
(4)1 :1 3 :1 29g/mol
【解析】
试题分析:(1)由n=![]() 可知,物质的量相等,则分子数相等,为1:1:1,它们的分子个数比为1:1:1;质量比为:(1×28):(1×44):(1×64)=7:11:16;由n=
可知,物质的量相等,则分子数相等,为1:1:1,它们的分子个数比为1:1:1;质量比为:(1×28):(1×44):(1×64)=7:11:16;由n=![]() 可知,它们的物质的量之比为1:1:1,则体积之比为1:1:1。
可知,它们的物质的量之比为1:1:1,则体积之比为1:1:1。
(2)设质量均为mg,则物质的量分别为![]() mol、
mol、![]() mol、
mol、![]() mol、
mol、![]() mol,同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①;由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,44>32>16>2,即密度由大到小的顺序为①③④②,故答案为:②④③①,①③④②。
mol,同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①;由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,44>32>16>2,即密度由大到小的顺序为①③④②,故答案为:②④③①,①③④②。
(3) 由CaR2含R-0.4 mol,得n(CaR2)==0.2 mol,所以M(CaR2)=m(CaR2)/n(CaR2)=22.2 g/0.2 mol=111 g·mol-1,而M(R)=![]() =
=![]() =35.5g·mol-1。
=35.5g·mol-1。
(4) 根据n=![]() 计算物质的量,混合气体中N2和NO的物质的量之比为
计算物质的量,混合气体中N2和NO的物质的量之比为![]() :
:![]() =1:1,设混合气体都为1mol,则混合气体中氮原子的物质的量为3mol,氧原子的物质的量为1mol,根据N=n×NA,氮原子和氧原子的个数比为3:1,该混合气体的平均摩尔质量为:
=1:1,设混合气体都为1mol,则混合气体中氮原子的物质的量为3mol,氧原子的物质的量为1mol,根据N=n×NA,氮原子和氧原子的个数比为3:1,该混合气体的平均摩尔质量为:
M=![]() =
=![]() =29g/mol。
=29g/mol。


科目:高中化学 来源: 题型:
【题目】NaCl是海水中提取出来的一种重要物质,除可食用外,它还是一种重要的工业原料,下列以NaCl为原料的产品(或物质)是( )
① 烧碱 ② 纯碱 ③ 金属钠 ④ 氯气 ⑤ 盐酸 ⑥ NaClO
A.全部 B.①②③④⑤ C.①②③⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体NH5属于离子晶体。它与水反应的化学方程式为NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
A.含有NH4+和H-
B.NH5中N元素的化合价为+5价
C.1 mol NH5中含有5NA个N—H键
D.与乙醇反应时,NH5被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④CuS ⑤FeCl2 ⑥ CaSiO3
A.②④ B. ②④⑤ C.②③④⑤ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内,作为生命活动的体现者、遗传信息的携带者、膜结构的主要成分的化合物,依次为
A. 糖类、脂质、核酸 B. 蛋白质、磷脂、核酸
C. 蛋白质、糖类、核酸 D. 蛋白质、核酸、磷脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.78g 苯含有C=C双键的数目为3NA
B.1L 1mol·L -1的Na2CO3溶液中含有阴离子的数目大于NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①N2(g)+O2(g)=2NO(g) △H1=+180kJ·mol-1
②N2(g)+3H2(g)![]() 2NH3(g) △H2=-92.4 kJ·mol-1
2NH3(g) △H2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ·mol-1

下列说法正确的是
A.反应②中的能量变化如图所示,则△H2=E1-E3
B.N2的燃烧热为180 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为Q1kJ,则Q1=92.4
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将________;
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g) ![]() 2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。
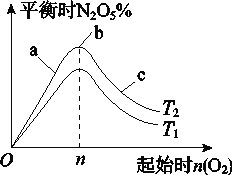
(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是________(填字母);
(3)若起始时NO2是4mol,容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液溶质物质的量浓度为1mol/L
C. 0.5L2mol·L-1的BaCl2溶液中,Ba2+和Cl-的总数为3×6.02×1023
D. 10g98%的硫酸(密度为1.84g·cm-3)与10mL18.4mol·L-1的硫酸的浓度不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com