
【题目】NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如图:

(1)在待镀件上镀镍时,待镀件应作____极,电镀过程中电解质溶液浓度___ (填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为_____________.当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10﹣5mol/L,则c(Cu2+)=______mol/L(已知Ksp(CuS)=1.3×10﹣36,Ksp(ZnS)=1.6×10﹣24).
(3)对滤液Ⅱ中先加H2O2再调pH,调pH的目的是______________________________________________________________________.
(4)为测定NiSO4·xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于__________________.
【答案】阴 不变 FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s) 8.1×10-18 mol·L-1 调节pH有利于Fe3+水解生成氢氧化铁沉淀而除去 6
【解析】
电镀废渣(除镍外,还含有铜、锌、铁等元素),加入稀硫酸过滤得到含有镍离子、铜离子、锌离子、亚铁离子的滤液,后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体。
(1)在待镀件上镀镍,待镀件作阴极,镀层金属镍做阳极,电解质溶液用镍离子的盐溶液,阴极析出的镍与阳极溶解的镍等量,故电解质溶液的浓度不变;
(2)向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s),
已知Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.6×10-24,当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10-5mol·L-1,则溶液中的c(S2-)=![]() =
=![]()
mol·L-1=1.6×10-19mol·L-1,则c(Cu2+)=![]() =
=![]() mol·L-1≈8.1×10-18 mol·L-1;
mol·L-1≈8.1×10-18 mol·L-1;
(3)对滤液Ⅱ先加过氧化氢,可氧化Fe2+生成Fe3+,调节pH有利于水解生成氢氧化铁沉淀而除去;
(4)26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=![]() ,解得x=6。
,解得x=6。


科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
(1)用物质A表示的反应速率为____。
(2)用物质B表示的反应速率为____。
(3)2s时物质B的转化率为_____。
(4)2s时物质A的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
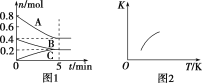
A.该反应可表示为2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.T ℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.T ℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对
与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强。 请仔细阅读上述材料,回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-_____________________________; PCl5_____________________。
(2) 有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
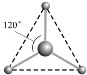 __________________;
__________________;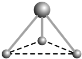 __________________。
__________________。
(3) 按要求写出第二周期非金属元素构成的中性分子的化学式:平面三角形分子___________,三角锥形分子___________,四面体形分子_____________。
(4) 下列一组微粒中键角由大到小顺序排列为____________________(用编号填写)
①HCN ②SiF4 ③SCl2 ④CO32- ⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。

①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________。

(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。
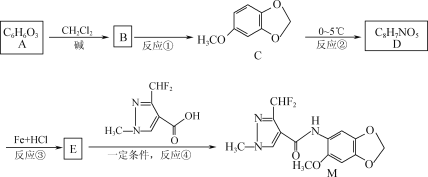
已知:
![]()
回答下列问题:
(1)化合物C中的含氧官能团为____________,反应④的反应类型为____________。
(2)写出E的结构简式:________________________。
(3)写出反应②的化学方程式:_____________________________________________。
(4)写出化合物C满足下列条件的一种同分异构体的结构简式:_________________。
① 含苯环结构,能在碱性条件下发生水解;
② 能与FeCl3发生显色反应;
③ 分子中含有4种不同化学环境的氢。
(5)已知CH3CH2CN![]() CH3CH2COOH。请以
CH3CH2COOH。请以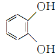 、CH2==CHCN和乙醇为原料合成化合物
、CH2==CHCN和乙醇为原料合成化合物 ![]() ,写出制备的合成路线流程图(无机试剂任用)_____。
,写出制备的合成路线流程图(无机试剂任用)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示。则下列结论正确的是( )

A.该反应的热化学方程式M(g)+3N(g)![]() 2R(g)△H>0
2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出NaHSO4在熔融状态下的电离方程式 _______。
(2)写出NaHCO3在水溶液中的电离方程式 ________。
(3)1mol乙烷气体(C2H6)在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ,写出乙烷燃烧热的热化学方程式________。
(4)含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7KJ的热量,表示该反应的热化学方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com