
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与 pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(选填序号,下同),水的电离程度相同的是_________;
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②______③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液 pH_____________7。
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH______7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________(填序号)。
A.酸性 B.碱性 C.中性
【答案】⑥ ②③④ > > < c(CH3COO-)>c(Na+)> c(CH3COOH)>c(H+)>c(OH-) ABC
【解析】
(1)水属于弱电解质,存在电离平衡H2O![]() H++OH-,根据电离出的离子可知酸或碱是抑制水的电离,而盐类的水解则是促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的。因为②③④溶液中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的;故其中水的电离程度最大的是⑥,水的电离程度相同的是②③④;
H++OH-,根据电离出的离子可知酸或碱是抑制水的电离,而盐类的水解则是促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的。因为②③④溶液中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的;故其中水的电离程度最大的是⑥,水的电离程度相同的是②③④;
(2)pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以②③等体积混合后氨水过量,溶液显碱性,要使溶液显中性,盐酸的体积必须大于氨水的体积,故答案为>;
②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,充分反应后氨水过量,溶液呈碱性,pH>7;
(3)若将①0.01mol/LCH3COOH溶液、④pH=12的NaOH溶液按体积比为2:1混合后,所得溶液为醋酸和醋酸钠按1:1形成的溶液,醋酸的电离程度大于醋酸根离子的水解,则c(CH3COO-)> c(CH3COOH),溶液显酸性c(H+)>c(OH-),故pH<7;此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:c(CH3COO-)>c(Na+)> c(CH3COOH)>c(H+)>c(OH-);
①④混合后,根据电荷守恒可知c(H+)+c(Na+)=c(OH-)+c(CH3COO-),若c(CH3COO-)>c(H+),则c(Na+)>c(OH-)。但c(H+)和c(OH-)的大小关系无法确定,所以该溶液可能显酸性、碱性或中性。答案选ABC。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】金属和非金属在人类生产生活中得到了广泛应用,请你回答下列问题。
(1)面包发酵粉的主要成分之一是一种钠盐,其俗称为________;漂白粉的有效成分为__________(写化学式);FeCl3常用作净水剂,其原理为_________(用离子方程式表示)。
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是_________。
(3)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(4)某CuSO4、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液中阳离子的浓度为___________mol/L,若向此溶液中加入金属Zn,则最多溶解Zn的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下化学反应的离子方程式书写正确的是( )
A. H2CO3电离:H2CO3![]() CO32-+2H+
CO32-+2H+
B. 将少量金属钠放入冷水中:Na+2H2O=Na+ +2OH-+H2↑
C. C12溶解于水:Cl2+H2O![]() 2H++ClO- +Cl-
2H++ClO- +Cl-
D. 向CuSO4溶液中通入H2S:Cu2+ +H2S=CuS↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Cu 组成的2.64g固体混合物投入适量稀稍酸中恰好完全反应,收集还原产物气体NO(还原产物只有一种)。然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下)体积为( )
A. 8.96LB. 0.896LC. 4.48LD. 0.448L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:______________。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:________。
(3)工业上制漂白粉的化学方程式为____________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________。
(4)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用18mol/L的浓硫酸配制500mL 3mol/L的稀硫酸,下列说法正确的是( )
A.应用量筒量取83.30mL的浓硫酸
B.在烧杯中溶解后,应立即转移至容量瓶中
C.加水定容时,若俯视刻度线,会使所配溶液浓度偏低
D.若未洗涤烧杯内壁并将洗涤液转移至容量瓶中,会使所配溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是有机合成工业中一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3+6Cl2![]() 4AlCl3+3O2。
4AlCl3+3O2。
(1)实验室制氯气的离子方程式为_________________________氯气溶于水生成的次氯酸的电子式为__________________________
(2)AlCl3可以作净水剂,其原理是(用离子方程式表示) ___________________________
(3)Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其离子方程式为________________
(4)为分析某铝合金的成分,用足量稀硝酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为5、9时过滤沉淀,继续滴加NaOH溶液无沉淀生成。结合图象信息推断该合金中除铝外还含有的金属是___________________________。
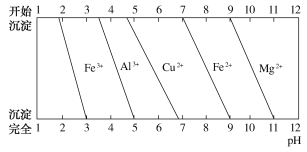
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中氧化剂是__________,还原剂是__________,请用双线桥表示电子转移数目_________________。当有l mol Cl2生成时,氧化剂与还原剂的物质的量之比为____________。
(2)3NO2 + H2O = 2HNO3 + NO中当电子转移4mol时,参加还原反应的NO2有__________mol,氧化产物与还原产物物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是
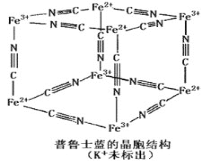
A. 化学式可以表示为KFe2(CN)6
B. 每一个立方体中平均含有24个π键
C. 普鲁士蓝不属于配位化合物
D. 每个Fe3+周围与之相邻的Fe2+离子有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com