
| A、Na+ NH4+ NO3- Cl- |
| B、K+ Na+ CO32- NO3- |
| C、K+ Ba2+ HCO3- Cl- |
| D、Na+ K+ MnO4- SO42- |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、Al>Mg=Fe>Na |
| B、Al=Mg=Fe=Na |
| C、Al=Mg=Fe<Na |
| D、Fe<Mg<Al<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2为还原剂 |
| B、NH4Cl为氧化产物 |
| C、常温常压下有2.24LN2生成时转移0.6mol电子 |
| D、有2molNH3被氧化就有8molNH3参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
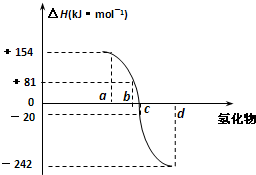 已知:在热力学标准状态下(298K、1.01×105Pa),由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H ).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.下列叙述不正确的是( )
已知:在热力学标准状态下(298K、1.01×105Pa),由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H ).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.下列叙述不正确的是( )| A、只有① | B、只有② |
| C、只有③ | D、只有①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸,Na2CO3溶液 |
| B、氯化铝溶液,氨水 |
| C、碳酸氢钠溶液,澄清石灰水 |
| D、溴化亚铁溶液,氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、3:2 |
| C、1:1 | D、1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、α1=α2=α3 |
| B、α1>α2>α3 |
| C、α1>α2=α3 |
| D、α1=α2<α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com