
| A、Na+、Fe2+、Cl-、ClO- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Mg2+、NH4+、SO42-、Cl- |
| D、Ba2+、HCO3-、NO3-、K+ |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol/L |
| B、1.5mol/L |
| C、1mol/L |
| D、0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg+、Na+、Cl-、NO3- |
| B、OH-、CO32-、Cl-、K+ |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 解释或结论 |
| A | 氢氧化钠标准液滴定食醋的操作中,用甲基橙作指示剂会造成误差 | 恰好完全中和时溶液呈碱性, 应选用酚酞作指示剂 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 往氯化铁溶液中加入氯化铁固体,溶液颜色加深 | 水解平衡向右移动,氢氧化铁浓度增大,氯化铁水解程度增大 |
| D | 在室温下能自发进行反应:(NH4)2CO3 (s)=NH4HCO3 (s)+NH3(g)△H>0 | 这是一个熵增的反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
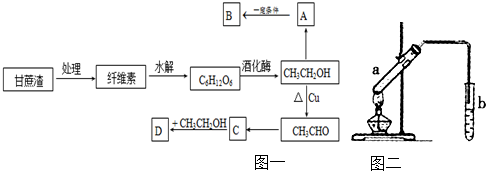
查看答案和解析>>
科目:高中化学 来源: 题型:
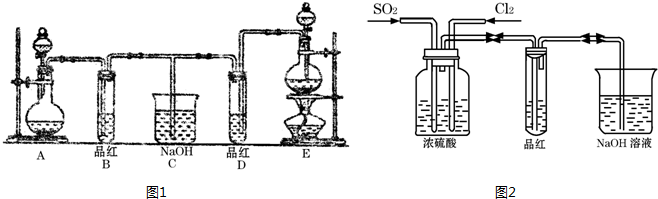
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com