
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 11.2LH2含有的原子数目为NA
B. 27 g Al变为Al3+时失去的电子数目为NA
C. 1 mol·L-1 CaCl2溶液中含有的Cl-离子数目为2NA
D. 常温常压下,6.4 g O2和O3的混合气体中含有的原子数为0.4NA
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氨气极易溶于水,因此液氨可作制冷剂
B. 浓硝酸遇到铁、铝会钝化,在任何情况下都不反应
C. 稀硝酸和铜反应需要加热
D. 碳铵,指的是碳酸氢铵,受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _____________kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_________(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH ______0。

③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25 mol/L,则CO的转化率=________,此温度下的平衡常数K=_________(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是___。A中反应的离子方程式是___。
(2)实验开始时先将止水夹a___(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程____。
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生的反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计实验探究乙烯与溴的加成反应。已知制取乙烯的化学方程式为:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
(1)甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是______(填编号)。
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的气体,未必是乙烯 D.使溴水褪色的气体,就是乙烯
(2)乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。乙同学推测此乙烯中可能含有的一种杂质气体是___________,在验证过程中必须全部除去。乙烯与溴水发生反应的化学方程式是______________________________,
(3)设计实验验证乙烯与溴水的反应是加成反应而不是取代反应:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子的球棍模型。下列关于该物质的说法正确的是

A. 能与醋酸发生中和反应 B. 能用于萃取碘水中的单质碘
C. 能使紫色石蕊试液变红色 D. 能与金属钠反应生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化工试剂,遇水剧烈水解。实验室可由氮气和钙加热制得氮化钙,实验装置如下图(省略部分固定装置)。
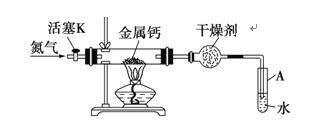
(1)氮化钙中所含的化学键有(填“共价键”或“离子键”)_________。
(2)球形干燥管中的干燥剂可选用(至少写一种)_________,结合化学方程式解释其作用_________。
(3)制备过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速;②_________。
(4)制备氮化钙的操作步骤:①按图示连接好实验装置;②_________;③打开活塞K并通入N2;④点燃酒精灯,进行反应;⑤反应结束后,熄灭酒精灯,继续通N2,使装置冷却至室温;⑥拆除装置,取出产物。
(5)上述步骤中③和④_________(填“能”或“不能”)交换,理由是_________。
(6)氮气不足会影响实验制得Ca3N2的纯度。为测定氮化钙的纯度,实验结束后取一定量的固体混合物于足量水中,微热使气体完全逸出,收集到气体共6.72 L(已折算到标准状况),将该气体通入装有足量灼热CuO的硬质玻璃管中充分反应,测得硬质玻璃管中固体质量减轻6.4 g。则Ca3N2的纯度为_________(用百分数表示,保留一位小数)(注:氨气能被灼热氧化铜氧化,生成一种对环境无污染气体)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中不属于化学变化的是
A. 紫色的石蕊试液中通入CO2后变色B. SO2漂白草编制品
C. 木炭使红棕色的NO2气体褪色D. 淀粉遇碘变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com