
| 点燃 |
| 点燃 |


科目:高中化学 来源: 题型:
| A、氯化铁溶液中加入足量铁粉,充分振荡 |
| B、氯化铁溶液中滴加硫氰化钾(KSCN)溶液 |
| C、氧化铜固体加入稀盐酸中,完全溶解 |
| D、碳酸氢钠溶液中滴加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
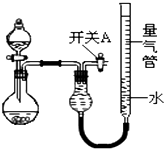 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com