
【题目】把10.2g Na2CO3·10H2O和NaHCO3组成的固体混合物溶于水配成100 mL溶液,其中c(Na+)=0.8 mol·L-1。若把等质量的固体混合物加热至恒重,残留固体的质量是( )
A.3.18 gB.2.12 gC.4.24 gD.5.28 g
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
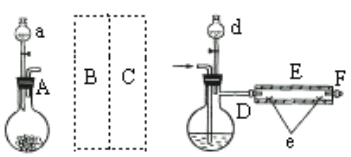
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为![]() ,且
,且![]() ,
,![]() 层电子数为a+b,则下列叙述不正确的是( )
层电子数为a+b,则下列叙述不正确的是( )
A.![]() 元素位于元素周期表中第3周期ⅣA族
元素位于元素周期表中第3周期ⅣA族
B.![]() 、
、![]() 两元素可形成化合物
两元素可形成化合物![]()
C.![]() 、
、![]() 两元素所形成的化合物能与碳反应
两元素所形成的化合物能与碳反应
D.![]() 、
、![]() 两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSe 、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 均为原子序数小于18的常见元素,且原子序数依次增大。已知
均为原子序数小于18的常见元素,且原子序数依次增大。已知![]() 原子最外层电子数与核外电子总数之比为
原子最外层电子数与核外电子总数之比为![]() ,
,![]() 原子的最外层电子数与次外层电子数之比为
原子的最外层电子数与次外层电子数之比为![]() ;
;![]() 比
比![]() 的原子序数小1;
的原子序数小1;![]() 与
与![]() 的电子层结构相同;化合物
的电子层结构相同;化合物![]() 在常温下为气体。请回答下列问题:
在常温下为气体。请回答下列问题:
(1)写出![]() 的简单离子的结构示意图:______。
的简单离子的结构示意图:______。
(2)由![]() 、
、![]() 、
、![]() 三种元素形成的盐的化学式为____________。
三种元素形成的盐的化学式为____________。
(3)![]() 与
与![]() 可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________。
可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________。
(4)写出![]() 的单质的一种工业用途:____________。
的单质的一种工业用途:____________。
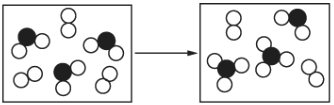
(5)如图表示由上述元素中的某两种元素组成的气体分子在密闭容器中,一定条件下充分反应前后的转化关系,该转化过程的化学方程式为____________。
(6)![]() 是由
是由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素组成的一种化合物,已知
四种元素组成的一种化合物,已知![]() 既能与盐酸反应,又能与
既能与盐酸反应,又能与![]() 溶液反应,还能和氯水反应,写出
溶液反应,还能和氯水反应,写出![]() 与氯水反应的离子方程式:__________________。
与氯水反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,对于指定项目的数目前后相等的是 ( )
A.电子数:17gOH—与1mol-OH
B.双键数目:1mol![]() 与4mol C2H4
与4mol C2H4
C.分子数:常温常压下16g氧气与4g氦气
D.阴离子总数:72gCaO2与62g Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子的最外层电子数是内层电子数的3倍,Y与X能形成两种化合物,Z所在的周期序数与族序数相同。下列说法正确的是( )
A.Y的单质能从Z的盐溶液中置换出Z
B.简单氢化物的热稳定性:![]()
C.Z与X两元素不能形成阴离子
D.简单离子的半径大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半径和化合价信息如下表所示:
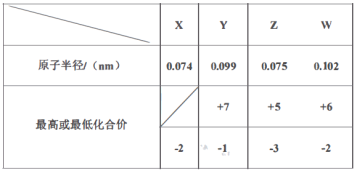
M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是___;构成化合物M2X2的化学键类型是___。
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式___。
(3)Y与W相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式___。
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式___,Z2R4与磷酸形成的磷酸二氢盐的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 ~ 18号元素(除稀有气体元素外)中的三种元素![]() 、
、![]() 、
、![]() ,已知它们的最高价氧化物对应的水化物的酸性由强到弱的顺序为
,已知它们的最高价氧化物对应的水化物的酸性由强到弱的顺序为![]() ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A.原子半径:![]()
B.非金属性:![]()
C.![]() 、
、![]() 、
、![]() 形成的简单阴离子的还原性逐渐减弱
形成的简单阴离子的还原性逐渐减弱
D.![]() 、
、![]() 、
、![]() 的简单氢化物的稳定性逐渐增强
的简单氢化物的稳定性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com