
【题目】短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种超原子![]() 具有40个价电子,下列说法错误的是( )
具有40个价电子,下列说法错误的是( )
A.![]() 的空间构型为平面三角形
的空间构型为平面三角形
B.简单离子半径:![]()
C.![]() 中心原子的杂化方式为
中心原子的杂化方式为![]() 杂化
杂化
D.化合物ZY的结构与X的某种单质的结构相似
【答案】B
【解析】
X、Y、Z是原子序数依次增大的短周期元素,Z的一种超原子![]() 具有40个价电子,则Z的价电子数为
具有40个价电子,则Z的价电子数为![]() 个,Z为Al元素,Y元素基态原子的核外p电子数比s电子数少1个,Y为N元素,X元素基态原子有2个未成对电子,X为C元素,据此分析解答。
个,Z为Al元素,Y元素基态原子的核外p电子数比s电子数少1个,Y为N元素,X元素基态原子有2个未成对电子,X为C元素,据此分析解答。
A.CO32-的中心原子的价电子对数为![]() ,不含孤电子对,采用sp2杂化,空间构型为平面三角形,A选项正确;
,不含孤电子对,采用sp2杂化,空间构型为平面三角形,A选项正确;
B.N3-与Al3+的核外电子层数相同,而N的核电荷数小于Al,则离子半径:N3->Al3+,B选项错误;
C.NO3-的中心原子的价电子对数为![]() ,不含孤电子对,采用sp2杂化,C选项正确;
,不含孤电子对,采用sp2杂化,C选项正确;
D.化合物ZY为AlN,是原子晶体,属于类金刚石氮化物,与C的单质金刚石结构相似,D选项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=_____,醋酸的电离平衡常数Ka=______。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:
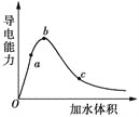
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_______c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | HCN |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-10 |
请回答下列问题:
①H2CO3的第二级电离平衡常数的表达式Ka2=_______。
②25℃时,向0.1molL-1的氨水中缓缓通入CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是___。
A.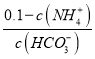 B.
B.![]() C.
C.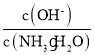 D.
D.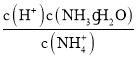
③向NaCN溶液中通入少量CO2气体,发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学课外活动小组欲检验茶叶中铁元素,设计了如下实验方案:

请回答:
(1)操作①的名称是_____。
(2)加入6mol·L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有____、_____。
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是______。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲乙两同学分别设计了如下装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

(1)甲装置中右边导管未插入溶液中的目的是 ______。
(2)实验结束后分离出乙酸乙酯的操作是 ____,必须用到的玻璃仪器有____(选择)。
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由____________(写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)![]() Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1
②S2(g)+2O2(g)![]() 2SO2(g) △H2
2SO2(g) △H2
③2Mo(s)+3O2(g)![]() 2MoO3(s) △H3
2MoO3(s) △H3
则2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)的△H=___(用含△H1、△H2、△H3的代数式表示)。
2MoO3(s)+4SO2(g)的△H=___(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s)![]() Mo(s)+S2(g)
Mo(s)+S2(g)
①下列说法正确的是___(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度____(填“>”“<”或“=”)1.4molL-1。
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应:S2(g)+2O2(g)![]() 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为____molL-1min-1。
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为____molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
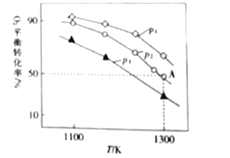
①△H____(填“>”“<”或“=”)0;比较p1、p2、p3的大小:___。
②若初始时通入7.0molO2,P2为7.0kPa,则A点平衡常数Kp=___(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。压强为p1,温度为1100K时,平衡常数Kp′___(填“>”“<”或“=”)Kp。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.5g钠、9g铝、28g铁分别投入200![]() 1
1![]() 的盐酸中,下列说法正确的是( )
的盐酸中,下列说法正确的是( )
A.钠与盐酸反应最剧烈,产生的气体最多
B.铝与盐酸反应的速率仅次于钠,但产生的气体最多
C.铁与盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论正确的是( )
A.该混合物中一定含有铝B.该混合物中一定含有铁
C.该混合物一定是由铁和镁组成的D.该混合物中一定不含铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力实验结果如图所示:
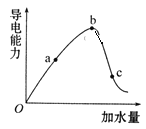
(1)“O”点为什么不导电?____________。
(2)比较a、b、c三点的c(H+)大小。____________(用“﹥”“=” 或“﹤”)
(3)a、b、c三点中,醋酸的电离程度最大的是哪一点?____________。
(4)若要使c点溶液中的c(CH3COO-)增大,试列举两条可行的措施______。
(5)在稀释过程中,c(H+)、n(H+)、c(OH-)和n(CH3COOH)中,始终保持增大趋势的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低
D.向水中加入少量固体醋酸钠,水的电离程度增大,Kw增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com