
【题目】PbO2是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由Ca(ClO)2溶液氧化碱性Pb(OH)2法制备PbO2的步骤如下:

2Pb(CH3COO)2+4NaOH+Ca(ClO)2=2PbO2↓+4CH3COONa+CaCl2+2H2O
(1)“氧化”过程中,反应液的pH____(填“变大”“变小”或“不变”)。
(2)“硝酸洗”时,被溶解的含铅杂质可能是____________(填化学式)。
(3)产品定性检验:向Mn(NO3)2的HNO3溶液中加入少量产品,搅拌并水浴微热,溶液变紫色,说明含有PbO2。该反应的离子方程式为____(PbO2被还原为Pb2+)。
(4)为测定产品(只含PbO2和PbO)中PbO2、PbO的物质的量之比,称取产品0.5194g, 加入20.00mL0.2500mol·L-1H2C2O4溶液(PbO2还原为Pb2+)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去PbC2O4,滤液酸化后用0.0400mol·L-1KMnO4标准溶液滴定至终点(MnO![]() 还原为Mn2+,H2C2O4被氧化为CO2),消耗标准溶液10.00mL。计算产品中n(PbO2) 与n(PbO) 物质的量之比(写出计算过程)____________。
还原为Mn2+,H2C2O4被氧化为CO2),消耗标准溶液10.00mL。计算产品中n(PbO2) 与n(PbO) 物质的量之比(写出计算过程)____________。
【答案】变小 Pb(OH)2 2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O 9:2
【解析】
根据流程可知,醋酸铅与Ca(ClO)2在碱性环境下,发生氧化还原反应,生成PbO2固体和醋酸钠溶液,过滤后得到二氧化铅,由于氢氧化钠与醋酸铅也可反应生成氢氧化铅,因此二氧化铅中含有杂质氢氧化铅,硝酸洗、水洗、干燥得到产品,据此进行分析。
(1)根据2Pb(CH3COO)2+4NaOH+Ca(ClO)2=2PbO2↓+4CH3COONa+CaCl2+2H2O反应可知,反应过程中不断消耗碱,碱性减弱,“氧化”过程中,反应液的pH变小;
故答案是:变小;
(2)醋酸铅也可和氢氧化钠溶液反应生成氢氧化铅沉淀;“氧化”制得的PbO2可能含有的含铅杂质化学式是Pb(OH)2;所以“硝酸洗”时,被溶解的含铅杂质可能是Pb(OH)2;
答案是:Pb(OH)2;
(3)根据题给信息可知,反应后的紫色溶液为MnO4-,因此Mn(NO3)2的HNO3溶液与PbO2反应的离子方程式为:2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O;
故答案是:2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O;
(4)上述过程发生的反应有:6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O;PbO2+2 H2C2O4=PbC2O4+2CO2+2H2O;PbO+ H2C2O4=PbC2O4+H2O;根据反应关系可知,与高锰酸钾溶液反应的n(H2C2O4)=2.5×0.04×10×10-3=1×10-3mol;与PbO2、PbO反应的n(H2C2O4)=0.25×20×10-3-1×10-3=4×10-3mol;2n(PbO2)+n(PbO)=4×10-3mol;239g/mol×n(PbO2)+223 g/mol×n(PbO)=0.5194g,n(PbO2)=1.8×10-3mol;n(PbO)=4×10-4mol;所以产品中n(PbO2) 与n(PbO) 物质的量之比1.8×10-3mol:4×10-4mol=9:2;
故答案是:9:2。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
(2)在一定条件下,向2L恒容密闭容器中冲入1molCO2和3molH2发生反应②,5min时测得生成了0.4molH2O,求5min的反应速率v(H2)=__,写出一种能加快反应速率的措施___
(3)甲醇是电动汽车的理想燃料,工作原理如图所示:
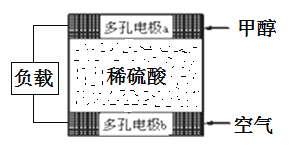
多孔电极b为燃料电池的__极(填“正”或“负”),多孔电极a发生的电极反应式为:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是
A. NaOH(aq) ![]() Cu(OH)2悬浊液
Cu(OH)2悬浊液![]() Cu2O
Cu2O
B. NH3![]() NO
NO![]() HNO3
HNO3
C. MgC12(aq)![]() 无水MgC12
无水MgC12![]() Mg
Mg
D. CaCl2(aq)![]() CaCO3
CaCO3![]() CaO
CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6 mol CO2和8 mol H2,发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH =-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH =-49.0kJ·mol-1
测得n(H2)随时间变化如曲线Ⅰ所示。下列说法正确的是
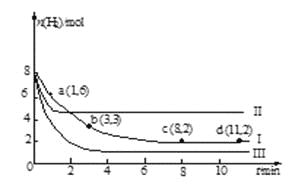
A. 该反应在0~8 min内CO2的平均反应速率是0.375mol·L-1·min-1
B. 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20%
C. 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2![]() 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2和6.0体积的H2和4.0体积的NH3
C. 4.0体积的NH3和1.0体积的H2
D. 2.0体积的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2LiAlH4![]() 2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
A. 若反应①中生成3.36L氢气,则一定有2.7g铝生成
B. 氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
C. 生成等质量的氢气,反应①②转移电子数之比为4:3
D. LiAlH4是共价化合物,LiH是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)热化学方程式C(s) + H2O(g) ![]() CO(g) + H2(g);△H = +131.3 kJ/mol表示________
CO(g) + H2(g);△H = +131.3 kJ/mol表示________
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸收131.3kJ 热量
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
(2)下列离子方程式中,属于水解反应的是_______________
A、CH3COOH+H2O![]() CH3COO— + H3O+ B、CO2+H2O
CH3COO— + H3O+ B、CO2+H2O![]() HCO3— + H+
HCO3— + H+
C、CO32— + H2O![]() HCO3— + OH— D、HS— + H2O
HCO3— + OH— D、HS— + H2O![]() S2— + H3O+
S2— + H3O+
(3)有A、B、C、D四块金属片,进行如下实验,
①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为___________
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
(4)在一定条件下,下列反应:2SO2 (g)+O2 (g)=2SO3 (g) ΔH<0达到平衡状态
①该反应的化学平衡常数表达式是__________________________
②其他条件不变时降低温度,二氧化硫的转化率______________,(填“增大”、“不变”、“减少”)化学反应速率_________________(填“增大”、“不变”、“减少”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素,X、Z和W的原子最外层电子数之和为20。回答下列问题:
(1) W在元素周期表中的位置是__________。
(2)X和Y元素简单离子的半径较大的是________(填离子符号);Z和W元素气态氢化物的稳定性较弱的是__________(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是__________(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com