
����Ŀ��ij��ѧ��ȤС����ʵ������ȡƯ�ۣ���̽��������ʯ���鷴Ӧ�������Ͳ��
��֪���ٶ���������Ũ���ᷴӦ���Ʊ�������ͬʱ����MnCl2
�������ͼ�ķ�ӦΪ���ȷ�Ӧ���¶Ƚϸ�ʱ�������ͼ�ܷ������·�Ӧ��3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
����ȤС�����������ʵ��װ�ã�����ʵ�顣
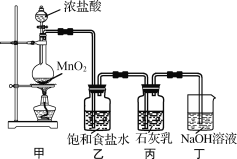
��ش��������⣺
��1���ټ�װ�������Ʊ���������װ�õ�������__��
��ʵ����������NaOH��Һ���մ�Ũ�����MnO2��Ӧ��ϵ�е��������塣�������¶Ȳ�ͬʱ�����ɵIJ��������NaClO��NaClO3��NaCl�е����ֻ����֡�����˵������ȷ����_��������ĸ��
A��������ΪNaClO3��NaCl����μӷ�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ1��5
B��������ΪNaClO��NaCl�������պ����Һ��n(NaClO)=n(NaCl)
C��������ΪNaClO��NaClO3��NaCl����NaOH��Cl2���Ӧ�����ʵ���֮��Ϊ2��1
��2��С���Ա���֣�������Ca(ClO)2����������С������ֵ���������ۺ���Ϊ�������ԭ���Dz�������δ��ʯ���鷴Ӧ���ݳ����Լ��¶����ߡ�Ϊ��̽����Ӧ�����Բ����Ӱ�죬������ȡһ������ʯ���飬�������ٵ�ͨ�������������ó���Ca(ClO)2��Ca(ClO3)2�������ʵ����ʵ�����n���뷴Ӧʱ�䣨t���Ĺ�ϵ���ߣ����Ա�ʾΪ��ͼ(������������ˮ�ķ�Ӧ)��
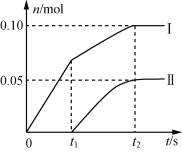
��ͼ������II��ʾ__(�����ʵĻ�ѧʽ)�����ʵ����淴Ӧʱ��仯�Ĺ�ϵ��
����ȡʯ�����к���Ca(OH)2�����ʵ���Ϊ__mol��
���𰸡���ȥ�����л��е��Ȼ��� AB Ca(ClO3)2 0.5
��������
��1��������Ũ������ȡ�������г�����HCl���壬HClҲ����Ca(OH)2������Ӧ��ʹ����Ч�ɷֺ������ͣ���Ҫ���ӣ���װ�õ����þ������ڳ�ȥ�����е�HCl�����dz�ȥ�����л��е��Ȼ��⣻
��A��������ΪNaClO3��NaCl����ѧ����ʽ6NaOH+3Cl2=5NaCl+NaClO3+3H2O�����ݷ���ʽ��֪���������ϼ����ߵõ�NaClO3��ֻ��0.5mol�����������ϼ۽��͵õ�NaCl��2.5mol������������ԭ����Ϊ�����������ʵ���֮��Ϊ2.5��0.5=5��1��A�����
B��Ũ�����MnO2��Ӧ��ϵ�е����������к�������HCl��������NaOH��Ӧ����NaClO��NaCl�ķ���ʽ2NaOH+Cl2=NaCl+NaClO+H2O��NaClO��NaCl�����ʵ���֮��Ϊ1��1������HClҲ����NaOH��Ӧ����NaCl����˱���������1��1��B�����
C��������NaCl��NaClO����NaClO3�У�Na��Cl�ı�����Ϊ1��1��1mol�����к���2mol Clԭ�ӣ�����ԭ���غ㣬��NaOH��Cl2�ı���Ϊ1��2��C����ȷ��
��ΪAB��
(2)�ٷ�Ӧ�տ�ʼ��ʱ��������Ca(OH)2����Ca(ClO)2����Һ���¶Ȳ����ߣ���Ȼ��Ӧ���ȣ��¶������ߣ�������Ca(OH)2��Ӧ����Ca(ClO3)2���������ߢ��ʾ����Ca(ClO3)2�����ʵ����淴Ӧʱ��仯�Ĺ�ϵ����ΪCa(ClO3)2���ڸ���ͼ���֪��Ca(ClO)2�����ʵ���Ϊ0.1mol��Ca(ClO3)2�����ʵ���Ϊ0.05mol�����ݻ�ѧ����ʽ2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O��6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O�����ܹ�����Ca(OH)2�����ʵ���Ϊ0.1mol��2+0.05mol��6=0.5mol����Ϊ0.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�����ֳ���Ԫ�صĵ��ʣ��ס��������ֳ����Ļ������Щ���ʺͻ�����֮�������ͼ��ʾ��ת����ϵ����Ӧ�����ԣ�������˵������ȷ���ǣ�������
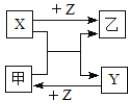
A.�ס������ֻ�����ֻ��ͨ�����Ϸ�Ӧ�õ�
B.X�ȿ����ǽ���Ԫ��Ҳ�����Ƿǽ���Ԫ��
C.���ڳ����£��ȿ�������̬Ҳ������Һ̬����̬
D.��X��Y�Ƿǽ���Ԫ�أ���ǽ�����X��Yǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ�ǰ��������ʵ�鷽���Ʊ������������壺����ȡ��������ˮ�ڽྻ���ձ��У��þƾ��Ƽ��������ڣ����ձ�����εμӱ��͵�FeCl3��Һ������У���Һ������ĺ��ɫ��
(1)������Ӧ�Ļ�ѧ����ʽΪ______,�жϽ����Ʊ��Ƿ�ɹ��������ý����____________ ��
(2)�����Ʊ��������������ʵ��ʱ����Щͬѧû�а�Ҫ����У����û�й۲쵽���壬����Ԥ����������ԭ��
�ټ�ͬѧû��ѡ�ñ����Ȼ�����Һ�����ǽ�ϡ�Ȼ�����Һ�����ˮ�У����û�й۲쵽_____����ԭ����______________
����ͬѧ��ʵ����û��ʹ������ˮ������������ˮ�������__________��ԭ����___________
�۱�ͬѧ���ˮ�еμӱ����Ȼ�����Һ��ʱ����ȣ������_________��ԭ����________
(3)��ͬѧ��Ҫ���Ʊ���Fe(OH)3���壬����������Fe(OH)3��������μ�����ϡH2SO4��Һ�����������һϵ�б仯��
���ȳ��ֺ��ɫ������ԭ����_______________________________________
���������ܽ⣬�˷�Ӧ�����ӷ���ʽ��___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ����Һ(��H2O�⣬����CCl4��I2��I��)�л��յ⣬��ʵ��������£�
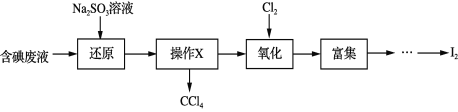
������������ȷ����
A. ������X��������Ϊ��ȡ�����ڷ�Һ©���н���
B. ����ԭ�����跢���ķ�ӦΪ��SO32+I2+H2O == 2I+SO42+2H+
C. �������������У�����˫��ˮ�������
D. ����������I2�������л��ܼ���ͬʱ��ȥijЩ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������![]() ��ϡ���ᷴӦ����Ӧ����̫����Ϊ�˼ӿ�˷�Ӧ���ʶ����ı�
��ϡ���ᷴӦ����Ӧ����̫����Ϊ�˼ӿ�˷�Ӧ���ʶ����ı�![]() �IJ���������ʹ�����·����еģ� ��
�IJ���������ʹ�����·����еģ� ��
�ټ�![]() �ڼ�
�ڼ�![]() ���� �۵��뼸��Ũ����
���� �۵��뼸��Ũ����
�ܸ���![]() ������ �ݼ�
������ �ݼ�![]() ��Һ �μӼ�������ͭ��Һ
��Һ �μӼ�������ͭ��Һ
�������¶ȣ�����������ӷ��� �����![]() ������
������
A. �ۢݢޢ�B. �ۢߢ�C. �ۢޢߢ�D. �ۢܢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯���������ǵ���������֡�
��1������β����NO���ɹ��̵������仯ʾ��ͼ��ͼ��
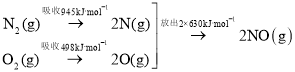
�������£�![]() ��
��![]() ��ȫ��Ӧ����
��ȫ��Ӧ����![]() ����___�����������������ų�����__kJ������
����___�����������������ų�����__kJ������
��2��һ���¶��£������Ϊ![]() �ĺ����ܱ������У�������̬������X��Y֮�䷴Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ��
�ĺ����ܱ������У�������̬������X��Y֮�䷴Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ��
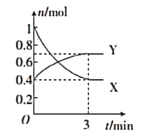
��д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��____�������ʵĻ�ѧʽ��ʾ��
����![]() �ڣ���Y��ʾ�ķ�Ӧ����Ϊ____��
�ڣ���Y��ʾ�ķ�Ӧ����Ϊ____��
������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����____������ĸ����
a.������ѹǿ���ٷ����仯
b.X������������ٷ����仯
c.������ԭ���������ٷ����仯
d.��ͬʱ��������![]() ��ͬʱ����
��ͬʱ����![]()
�ܷ�Ӧ�ﵽƽ����������¶ȣ���v������____��v���棩___����������������С����������������
��3����Ӧ![]() �����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
��![]() ��
��![]()
��![]() ��
��![]()
�÷�Ӧ�����ֲ�ͬ����������ɴ�С��˳��Ϊ���������գ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ȼ�Ľṹ��ʽ���Ա�ʾΪ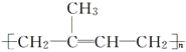 ����������Լ���ƿ����ʹ����Ƥ������
����������Լ���ƿ����ʹ����Ƥ������
A. ��B. ��ˮC. Na2CO3��ҺD. ����KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��Ʊ��빤ҵ�����������
��NH3![]() NO
NO![]() HNO3
HNO3
��ŨHCl![]() Cl2
Cl2![]() Ư��
Ư��
��MgCl2(aq)![]() ��ˮMgCl2
��ˮMgCl2![]() Mg
Mg
������NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
��������![]() NaAlO2��Һ
NaAlO2��Һ![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
A.�٢ڢ�B.�٢ܢ�C.�ڢۢ�D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��ѧ��Դ�����þ��зdz�������ǰ�����Ժ�ˮΪԭ���Ʊ�MgCl2��NaOH�Ĺ����������£�
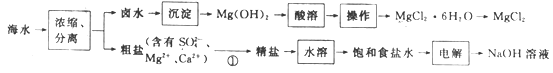
����˵���������
A.��������ʱ����ʯ������Ϊ������
B.�����ܡ�ʱ����������ᣬ�����ڵõ�MgCl2��6H2O����
C.����⡱ʱ��NaOH���������õ�
D.���̢ټ����Լ���˳������ΪNa2CO3��Һ��NaOH��Һ��BaCl2��Һ��ϡ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com