
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:________
(2)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为_______________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=—24.8 kJ·mol-1
3Fe2O3 (s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=—47.4 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)体和CO2(g)的热化学反应方程式:___________。
【答案】C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l) △H=-2900 kJ·mol-1 1:1 CO(g)+FeO(s) = Fe(s)+CO2(g) △H=-218.0 kJ·mol-1
O2(g)=4CO2(g)+5H2O(l) △H=-2900 kJ·mol-1 1:1 CO(g)+FeO(s) = Fe(s)+CO2(g) △H=-218.0 kJ·mol-1
【解析】
(1)1000g丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,则1g丁烷完全燃烧生成二氧化碳和液态水时,放出热量为![]() ,即50kJ。1mol丁烷的质量为58g,则1mol丁烷完全燃烧生成二氧化碳和液态水时,放出热量为58×50kJ=2900kJ,则表示丁烷燃烧热的热化学方程式为:C4H10(g)+
,即50kJ。1mol丁烷的质量为58g,则1mol丁烷完全燃烧生成二氧化碳和液态水时,放出热量为58×50kJ=2900kJ,则表示丁烷燃烧热的热化学方程式为:C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l) △H=-2900 mol·L-1,故答案为:C4H10(g)+
O2(g)=4CO2(g)+5H2O(l) △H=-2900 mol·L-1,故答案为:C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l) △H=-2900 kJ·mol-1;
O2(g)=4CO2(g)+5H2O(l) △H=-2900 kJ·mol-1;
(2)由C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1和2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1可知,1molC(s)完全燃烧放出393.5kJ热量,1molH2(g)完全燃烧放出![]() 热量,即241.8kJ。设混合物中C和H2的物质的量分别为xmol、ymol,则
热量,即241.8kJ。设混合物中C和H2的物质的量分别为xmol、ymol,则![]() ,解得:x=0.1,y=0.1,则混合物中C与H2的物质的量之比=0.1:0.1=1:1,故答案为:1:1;
,解得:x=0.1,y=0.1,则混合物中C与H2的物质的量之比=0.1:0.1=1:1,故答案为:1:1;
(3)①Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H1=-24.8 kJ·mol-1
②3Fe2O3 (s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H2=-47.4 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640.5 kJ·mol-1
![]() 得:CO(g)+FeO(s) = Fe(s)+CO2(g) △H=
得:CO(g)+FeO(s) = Fe(s)+CO2(g) △H=![]() =-218.0 kJ·mol-1,故答案为:CO(g)+FeO(s) = Fe(s)+CO2(g) △H=-218.0 kJ·mol-1。
=-218.0 kJ·mol-1,故答案为:CO(g)+FeO(s) = Fe(s)+CO2(g) △H=-218.0 kJ·mol-1。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】右图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
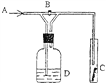
A. 浓H2SO4 B. 浓NaOH溶液
C. 饱和Na2SO4溶液 D. 石灰乳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
A. x=2
B. 2min时,B的浓度为0.4mol/L
C. 0~2min内B的反应速率为0.2mol·L-·min-
D. 此时A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均己略去。
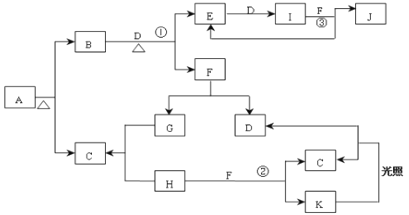
(1)写出它们的化学式:A__、C__、J__。
(2)写出②的离子反应方程式:__。
(3)写出③的化学反应方程式:__。
(4)红热的碳与J的浓溶液反应的化学方程式:__。
(5)J的浓溶液与单质Ag反应的离子方程式为:__。
(6)若86.4g银与含有1.4molJ的浓溶液恰好完全反应,则最终得到气体(NO、NO2)的总物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解饱和食盐水,下列分析错误的是
A.得电子能力H+>Na+,故阴极得到H2
B.水电离平衡右移,故阴极区得到OH-
C.失电子能力Cl->OH-,故阳极得到Cl2
D.OH-向阴极移动,故阳极区滴酚酞不变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为7:17,X与W同主族,Y的原子序数是W和X的原子序数之和的一半,含Z元素的物质在焰色反应实验中的焰色为黄色。下列判断正确的是
A.金属性:Y>ZB.非金属性:W>X
C.原子半径:W>Y>ZD.氢化物的热稳定性:X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。回答下列问题
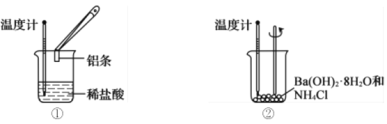
(1)装置①中反应物的总能量比生成物的总能量________(填标号)。
a.高 b.低 c.相等
(2)装置②中反应后溶液的温度__________(填标号)。
a.升高 b.降低 c.不变
(3)已知断裂1mo1共价键需要吸收的能量分别为 H —H :436kJ,I —I :151kJ,H— I :299kJ。则反应 H2+I2 = 2HI的能量变化为______(填标号)。
a.无能量变化 b.吸热 c.放热
(4)碱金属单质在空气中燃烧的产物与碱金属的活动性有关。锂单质在空气中燃烧得到的产物的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
①22gT2O含有电子数为10NA
②0.44gC3H8中含有的共价键总数目为0.1NA
③1molNa2O2与CO2完全反应时转移电子数为2NA
④28g硅晶体中含有2NA个Si—Si键
⑤11.2LCl2通入足量的NaOH溶液中充分反应,转移的电子数等于0.5NA
⑥200mL1mol·L-1Al2(SO4)3溶液中Al3+和SO42-的数目总和是NA
A.①②③B.②④⑥C.①③⑤D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com