
| A、周期表里,主族元素所在的族序数等于原子核外电子数 |
| B、周期表里,元素所在的周期序数等于原子核外电子层数 |
| C、元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共有16纵行 |
| D、X2+的核外电子数目为10,则X在第二周期第ⅡA族 |


科目:高中化学 来源: 题型:
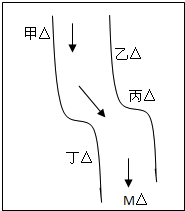 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是利用化学原理治理环境污染 |
| B、硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| C、大量使用风能、太阳能、生物质能,符合“低碳”理念 |
| D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | CH3CH3+Cl2
CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 | ||
| B | 明矾用于净水 碳酸钠溶液显碱性 | 均发生了水解反应 | ||
| C | Cl2+2Br?=2Cl?+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 | ||
| D | 2Na2O2+2H2O=4NaOH+O2↑ Cl2+H2O=HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol/L |
| B、3 mol/L |
| C、4 mol/L |
| D、8 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com