
【题目】已知NaCN溶液中CN-水解常数![]() 是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。
是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。

下列说法不正确的是
A. 其它条件不变,降低温度,可使b点变到a点
B. 相同温度时,c点对应溶液中的pH大于a点
C. 由图可知,25 ℃时,Kh(CN-)≈10-4.7
D. 向1 L lgc0=0的NaCN溶液中通入0.5 mol HCl气体,所得溶液中c(CN-)<c(HCN)
【答案】A
【解析】
A.降低温度,CN-水解平衡向左移动,溶液中OH-浓度减小,2pOH增大,不能使曲线上的b点变到a点,故A错误;
B.根据pOH=-lgc(OH-),c点的2pOH小于a点2pOH,则c点对应溶液中的c(OH-)大于a点,因此c点对应溶液的pH大于a点,故B正确;
C.根据a点坐标(-1,5.7),即lgc0=-1,2pOH=5.7,即c0=0.1mol/L,c(OH-)=10-2.85mol/L,则Kh(CN-)=![]() =
=![]() =10-4.7,故C正确;
=10-4.7,故C正确;
D.lgc0=0的NaCN溶液中NaCN的浓度为1 mol/L,1 L lgc0=0的NaCN溶液含有1mol NaCN,通入0.5 mol HCl气体,NaCN+ HCl= HCN+NaCl,反应后溶液中含有等浓度的NaCN、HCN和NaCl,Kh(CN-)=10-4.7,NaCN的水解程度大于HCN的电离程度,则c(CN-)<c(HCN),故D正确;
答案选A。


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】将3.64 g Fe2O3和Al2O3的混合物溶于200 mL 0.1 mol/L盐酸中(盐酸过量),再向该溶液中加入NaOH溶液使Fe3+和Al3+恰好完全沉淀,用去NaOH溶液100 mL。则NaOH溶液的物质的量浓度是( )
A. 0.1 mol/L B. 0.2 mol/L C. 0.4 mol/L D. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钻合金是以铂为基含钻二元合金,在高温下,铂与钻可无限互溶,其固溶体为面心立方晶格。铂钻合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表电子钟表磁控管等。
(1)基态钴原子的价电子排布图为______。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示,每个分子中含有的σ键数目为______。二氯二吡啶合铂分子中所含的C、N、Cl三种元素的第一电离能由大到小的顺序是______。
②二氯二吡啶合铂中存在的微粒间作用力有______(填字母)。
a.范德华力b.氢键c.金属键d非极性键
③反式二氯二吡啶合铂分子是______(填“极性分子”或“非极性分子”)。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。

①“分子金属”可以导电,是因为______能沿着其中的金属原子链流动。
②“分子金属”中,铂原子是否以sp3的方式杂化?______(填“是”或“否”),其理由是______。
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是______(填字母)。

(5)金属铂品体中,铂原子的配位数为12,其立方晶胞沿式x、y或z轴的投影图如图所示,若金属铂的密度为dgm-3,则晶胞参数a=______nm(列计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是________,其中含有_______mol SO42-,______mol H,含有______g O。
(2)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol/L。
(3)若从中取出50 mL,其物质的量浓度为_______ mol/L;溶质的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)为二元碱,25℃时向联氨水溶液中逐滴滴加盐酸溶液,混合溶液中的微粒的物质的量分数随pOH[pOH=-lgc(OH-)]变化的关系如图所示。已知联氨的两步电离分别为:N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。下列叙述错误的是
N2H62++OH-。下列叙述错误的是

A. 联氨的第一步电离平衡常数Kb1=10-6
B. pOH=6时c(N2H4)与pOH=15时c(N2H62+)相同
C. 当溶液中c(N2H62+)︰c(N2H5+)=1︰1时,c(H+)=10mol/L
D. pOH由12增大到18时,对应的离子方程式为:N2H5++H+=N2H62+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
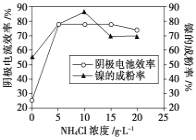
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com