
【题目】将浓度均为![]() 的
的![]() 与
与![]() 溶液各
溶液各![]() 混合,以铜为电极进行电解,一段时间后阴极上有
混合,以铜为电极进行电解,一段时间后阴极上有![]() 铜析出,则:
铜析出,则:
(1)电路上通过电子的物质的量:________________
(2)电解后溶液中c(Cu2+) ____________________
【答案】![]()
![]()
【解析】
按照离子放电顺序,阴极电极反应顺序是Ag++e-=Ag、Cu2++2e-=Cu、H++2e-=H2↑,混合液中n(Ag+)=0.5L×2mol·L-1=1mol,n(Cu2+)=0.5L×2mol·L-1=1mol,因为得到1.6gCu,因此推出Cu2+没有完全被电解,据此分析;
(1)电解![]() 、
、![]() 的混合液,首先在阴极上得电子的是
的混合液,首先在阴极上得电子的是![]() ,
,![]() ,其次是
,其次是![]() ,
,![]() ,在阳极上是铜失电子的过程,
,在阳极上是铜失电子的过程,![]() ,混合液中n(Ag+)=0.5L×2mol·L-1=1mol,Ag+全部被电解,此时得电子1mol,阴极上有
,混合液中n(Ag+)=0.5L×2mol·L-1=1mol,Ag+全部被电解,此时得电子1mol,阴极上有![]() Cu,即
Cu,即![]() 析出,根据电极反应:
析出,根据电极反应:![]() ,此时转移电子是
,此时转移电子是![]() ,消耗Cu2+是
,消耗Cu2+是![]() ,电路上通过电子的物质的量为(1mol+0.05mol)=1.05mol;
,电路上通过电子的物质的量为(1mol+0.05mol)=1.05mol;
答案为:1.05mol;
(2)铜作阳极,阳极反应式为Cu-2e-=Cu2+,当转移1.05mole-时,阳极上会有![]() =0.525molCu2+进入电解质,根据(1)分析,原混合溶液中还剩下n(Cu2+)=1mol-0.025mol=0.975mol,此时溶液中共含有n(Cu2+)=0.975mol+0.525mol=1.5mol,c(Cu2+)=
=0.525molCu2+进入电解质,根据(1)分析,原混合溶液中还剩下n(Cu2+)=1mol-0.025mol=0.975mol,此时溶液中共含有n(Cu2+)=0.975mol+0.525mol=1.5mol,c(Cu2+)=![]() =1.5mol·L-1;
=1.5mol·L-1;
答案:1.5mol·L-1。


科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
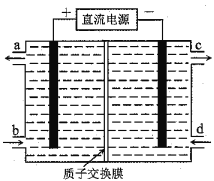
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下发应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
A. 5 min 内D的平均反应速率为0.02 mol·L-1·min-1
B. 第5min时C的反应速率为0.06 mol·L-1·min-1
C. 经5min后,向容器内再加入A,正反应速率变大
D. 平衡状态时,生成1molD时同时生成1molA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJB.2953kJC.3236kJD.3867kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A. 稀释2倍后,两溶液的pH:盐酸小于醋酸
B. 盐酸和醋酸分别与Zn反应放出的氢气一样多
C. 盐酸和醋酸分别与Zn反应的速率一样大
D. 稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 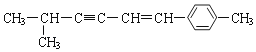 说法正确的是
说法正确的是
A.该分子中所有的碳原子均可能处于同一平面上
B.该分子中一定共面的碳原子数至少为8个
C.该分子中至少有9个碳原子处于同一条直线上
D.该分子中可能处于同一平面的原子总数最多为18个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com