
【题目】(1)FeCl3溶液呈_______性,原因是__________(用离子方程式表示)。把FeCl3溶液蒸干后并灼烧,最后得到的主要固体产物是_________。
(2)在25℃下,将a mol·L-1的CH3COOH与0.01 mol·L-1的NaOH等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+),则溶液显______ (填“酸”、“碱”或“中”)性;用含a的代数式表示CH3COOH的电离常数Ka=__________ 。
(3)已知298 K和101 kPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______________。
【答案】酸 Fe3+ + 3H2O![]() Fe(OH)3 + 3H+ Fe2O3 中
Fe(OH)3 + 3H+ Fe2O3 中 ![]() 3/2ΔH2―ΔH1― 1/2ΔH4
3/2ΔH2―ΔH1― 1/2ΔH4
【解析】
(1)FeCl3是强酸弱碱盐,铁离子水解而使其溶液呈酸性;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到氢氧化铁,灼烧时,Fe(OH)3分解,据此解答;(2)根据电荷守恒判断混合溶液中c(H+)、c(OH-)相对大小,确定溶液酸碱性;根据醋酸的电离平衡常数表达式及溶液中醋酸、醋酸根离子和氢离子浓度进行计算;(3)根据盖斯定律,结合题干中已知热化学方程式计算N2H4(l)+O2(g)=N2(g)+2H2O(l)的反应热。
(1)FeCl3是强酸弱碱盐,铁离子水解生成Fe(OH)3和HCl而使其溶液呈酸性,水解方程式为Fe3++3H2OFe(OH)3+3H+;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到氢氧化铁,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3![]() Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,故答案为:酸;Fe3++3H2OFe(OH)3+3H+;Fe2O3;
Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,故答案为:酸;Fe3++3H2OFe(OH)3+3H+;Fe2O3;
(2)根据电荷守恒有c(CH3COO-)+ c(OH-)=c(Na+)+ c(H+),当c(CH3COO-)=c(Na+),则c(H+)=c(OH-),溶液呈中性; 在25℃下,将amolL-1的稀醋酸与0.01molL-1的NaOH溶液等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+)=0.005mol/L,根据电荷守恒可得c(OH-)=c(H+),所以溶液显示中性,常温下的中性溶液中c(OH-)=c(H+)=10-7mol/L,根据物料守恒可得,c(CH3COOH)=0.5amo/L-0.005mol/L=(0.5a-0.005)mol/L,醋酸的电离平衡常数为:Ka=![]() =
=![]() =
=![]() ,故答案为:中;>;
,故答案为:中;>;![]() ;
;
(3)已知:①N2(g)+3H2(g)=2NH3(g)△H1,②2H2(g)+O2(g)=2H2O(l) △H2,③2H2(g)+O2(g)=2H2O(g) △H3,④4NH3(g)+O2(g)=2N2H4(l)+2H2O(l) △H4,由盖斯定律,将②×![]() -①-④×
-①-④×![]() 得:N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=
得:N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=![]() △H2-△H1-
△H2-△H1-![]() △H4,故答案为:
△H4,故答案为:![]() △H2-△H1-
△H2-△H1-![]() △H4。
△H4。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g)△H=-113.0kJmol-1,2SO2(g)+O2(g)
2NO2(g)△H=-113.0kJmol-1,2SO2(g)+O2(g)![]() 2SO3(g)△H=-296.6kJmol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
2SO3(g)△H=-296.6kJmol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为______________________________。
②随温度降低,该反应化学平衡常数变化趋势是______(填“增大”或“减小”或“不变”)。
(2)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在10L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是______(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,改用高效催化剂
d.在其他条件不变时,减少容器的体积
e.在其他条件不变时,升高体系温度
(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图

①电解饱和食盐水的化学方程式是__________________________;
②若用NaOH溶液吸收含二氧化硫的废气,当二者恰好完全反应生成NaHSO3时,溶液的PH<7,则该溶液中各离子浓度由大到小的顺序为_________________________;
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)A的元素符号______________,D的元素名称 ____________。
(2)C在周期表中的位置:___________,E的离子结构示意图________;
(3)B、C、E分别与A形成的化合物中最稳定的是________(写化学式);E、F的最高价氧化物对应的水化物的酸性较强的是________(写化学式)
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为________________。
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该方应的化学方程式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如下图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知,钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2,回答下列问题:
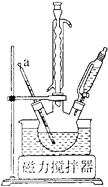
(1)仪器a的名称是_______,冷凝管的作用是________。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是________(填标号)。
a.增加反应的焓变 b.增大反应的活化能
c.减小反应的焓变 d.降低反应的活化能
制备过程中,减慢水解反应速率的措施还有________。
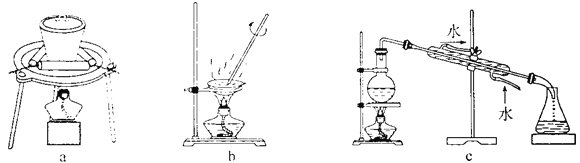
(3)步骤②中制备二氧化钛溶胶的化学方程式为________。下图所示实验装置中,可用于灼烧二氧化钛凝胶的是________(填标号)。
(4)测定样品中TiO2纯度的方法是:精确称取0.2000 g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000 mol·L-lNH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000 mol·L-1 NH4Fe(SO4)2溶液的平均值为20.00 mL(已知:Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是________________。
②滴定时所用的指示剂为____________(填标号)
a.酚酞溶液 b. KSCN溶液 c. KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)元素E在周期表中的位置为___________________________;
(2)把D的单质放到NaOH溶液中,反应的化学方程式为:_______________________;
(3)用电子式表示甲的形成过程:_________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,充分振荡并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的体积比为________________;
(5)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴等,可由白磷和单质硫化合而得。它们的结构如下:

依据下列键能数据,反应8P4(s)+3S8(s)=8P4S3(g)的ΔH为( )
化学键 | P—P | S—S | P—S |
键能/kJ·mol-1 | a | b | c |
A.24(a+b-2c) kJ·mol-1B.(32a+24b-24c) kJ·mol-1
C.(48c-24a-24b) kJ·mol-1D.(8a+3b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际奥委会于2010年2月10日宣布,有30名运动员因为兴奋剂药检呈阳性,从而被取消参加2010年温哥华冬季奥运会的资格。以下是其中检测出的两种兴奋剂的结构:

关于它们的说法中正确的是( )
A.1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH
B.1molX与足量的氢气反应,最多消耗2molH2
C.Y与足量的浓溴水反应,能产生白色沉淀
D.Y遇到FeCl3溶液时显紫色,但不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)CCl4是____色、比水____的液体。步骤⑤后静置,下层液体的颜色为______色,上层液体的成分为___________。该步骤所用主要玻璃仪器的名称是__________。
(2)能选用CCl4获取碘的原因是_____________________、___________________、_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com