
 各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.
各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| 0.02×0.042 |
| 0.162×0.062 |
| 0.01×0.022 |
| 0.182×0.082 |
| 0.07×0.022 |
| 0.182×0.142 |


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
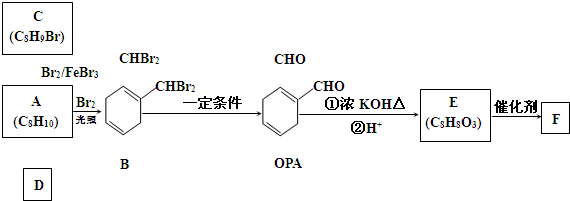

| 浓硫酸 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6种 | B、7种 | C、8种 | D、9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系比较正确的( )
在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系比较正确的( )| A、在A、B间任意一点,溶液中一定都有c(Na+)>cCH3COO-)>c(OH-)>c(H+) |
| B、在B点,a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)+c(CH3COOH)=2 c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要 储氢材料.
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要 储氢材料.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟利昂和NOX都能破坏臭氧层,从而导致“温室效应” |
| B、针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心 |
| C、光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| D、肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后不能全部都得到氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、常温下,儿茶素溶于水,也不溶于有机溶剂 |
| B、儿茶素一定不能发生水解反应 |
| C、儿茶素能与FeCl3溶液发生显色反应 |
| D、1mol儿茶素最少可与5molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com