


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 最高价氧化物对应的水化物化学式为H2XO3 |
| Y | 最外层电子数是次外层的3倍 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
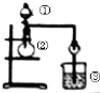
| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com