
����Ŀ��ҩ���м���(G)���л���ҩ��ҵ�е�һ�ֺϳɷ�������:
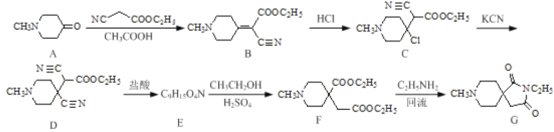
�ش���������:
(1)������D��G�к��������ŵ����Ʒֱ�Ϊ___________��_________��
(2)��B��C�ķ�Ӧ����Ϊ_____ ;д��C�� D��Ӧ�Ļ�ѧ����ʽ:________��
(3)������E�Ľṹ��ʽΪ________��
(4)��ӦF��G����һ����������___________��
(5)д��ͬʱ��������������B��ͬ���칹��Ľṹ��ʽ:_______��
����������Cu(OH)2���������·�Ӧ����ש��ɫ������ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ:
���˴Ź�������Ϊ�����,�������Ϊ1:2:4:9;
������������
(6)��֪:RCN![]() RCH2NH2�������HOOCCH2COOH��CH3CH2ClΪԭ���Ʊ�
RCH2NH2�������HOOCCH2COOH��CH3CH2ClΪԭ���Ʊ�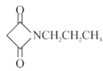 �ĺϳ�·��:_________(���Լ�����)��
�ĺϳ�·��:_________(���Լ�����)��
���𰸡����� �ļ� �ӳɷ�Ӧ 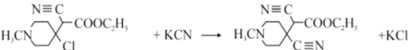
![]() CH3CH2OH
CH3CH2OH  ��
��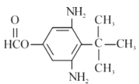
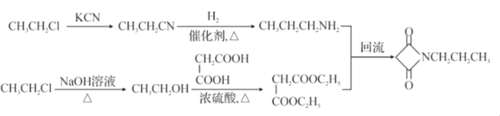
��������
A����ȡ����Ӧ����B��B��HCl�����ӳɷ�Ӧ����C��C��KCN����ȡ����Ӧ����D��D�����ᷴӦ������E���Ҵ�����������Ӧ����F������F�Ľṹ�Ƴ�E�Ľṹ��ʽΪ![]() ��F��C2H5NH2����ȡ����Ӧ����G���Ҵ���
��F��C2H5NH2����ȡ����Ӧ����G���Ҵ���
(1)����D��G�Ľṹ�ó�������D�к��������ŵ�����Ϊ������G�к��������ŵ�����Ϊ�ļ����ʴ�Ϊ���������ļ���
(2)����B��C�Ľṹʽ�ó���Ӧ����Ϊ�ӳɷ�Ӧ������C�� D��Ӧ�ó���ȡ����Ӧ���仯ѧ����ʽ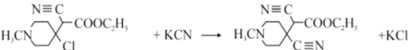 ���ʴ�Ϊ���ӳɷ�Ӧ��
���ʴ�Ϊ���ӳɷ�Ӧ��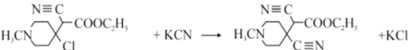 ��
��
(3)����E��F����������Ӧ�ó�������E�Ľṹ��ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)���ݷ�ӦF��G�еĽṹ�ó���ӦΪȡ����Ӧ�������һ����������CH3CH2OH���ʴ�Ϊ��CH3CH2OH��
(5)����������Cu(OH)2���������·�Ӧ����ש��ɫ������ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ��˵�����м�������γɵķ���������ȡ������Ϊ��OOCH���������к��а��������˴Ź�������Ϊ����壬�������Ϊ1:2:4:9�����ڶԳƽṹ�����ֺ���2����NH2,1����C(CH3)3������������ͬ���칹��Ϊ ��
�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
(6)CH3CH2Cl�ڼ���������ˮ��õ�CH3CH2OH��Ȼ����HOOCCH2COOH����������Ӧ�õ�CH3CH2OOCCH2COOCH2CH3��CH3CH2Cl��KCN����ȡ����Ӧ�õ�CH3CH2CN����������ԭ�õ�CH3CH2CH2NH2������F��G��ת�����̣�CH3CH2CH2NH2��CH3CH2OOCCH2COOCH2CH3��Ӧ�õ�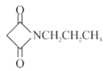 ���ϳ�·��Ϊ
���ϳ�·��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ�ĵ�ѭ������̬ϵͳ����ѭ������Ҫ���֣������Ӿ��˵�ѭ���е�����ת����
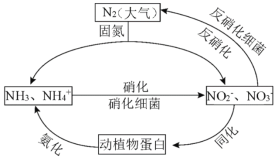
������˵����ȷ����_______������ĸ��ţ�
A.�̵������У�N2ֻ��������
B.����������Ҫ������������
C.�����������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ��
D.ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת��
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ��뽫�÷�Ӧ�����ӷ���ʽ����������5CH3OH+��NO3��![]() ��_______+��_______+��_______+��_______��_____________
��_______+��_______+��_______+��_______��_____________
��2���о��������������NOx���Ͷ���������������������γ��йء�
����֪��SO2����SO3�ܷ�Ӧ����ʽ��2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ/mol
2SO3(g)��H����196.6kJ/mol
�˷�Ӧ��ͨ������������ɣ�2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ/mol
2NO2(g)��H1����113kJ/mol
NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��_______��
SO3(g)��NO(g)��H2��_______��
��һ���¶��£���2L�����ܱ������г���NO2��SO2��1mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3����NO2��ƽ��ת������_______��
��3���飨As���ǵ������ڢ�A��Ԫ�أ��仯������Ź㷺����;��
��AsH3���ȶ��Ա�NH3���ȶ���_______������ǿ��������������������ԭ�ӽṹ����ԭ��_______��
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ_______��
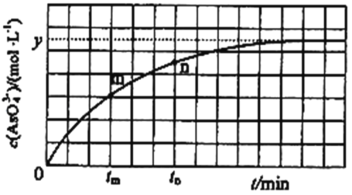
��298Kʱ����20mL3xmolL-1Na3AsO3��20mL3xmolL-1I2��20mLNaOH��Һ��ϣ�������Ӧ��AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��ZΪ������ԭ�������������������Ԫ�أ�����WԪ���γɵĵ����ܶ���С����W��X��Y��Z�����γɹ��ۻ�����,Y��W�γɵij�������������ˮ�Լ���,Z��W�γɵĻ���������ˮ�����ԡ�����Ԫ��ԭ������֮��Ϊ30�����γɵ�ij�ֻ�����ṹʽΪ ������˵����ȷ����
������˵����ȷ����
A.XΪ̼Ԫ��
B.Y���������Ӧ��ˮ������ǿ��
C.W��Y��Z����Ԫ���γɵĻ�������һ���������Ӽ�
D.��Z��ij�ֺ������ο������������ͻ����ȵ�ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����ʽΪC2H4���ɷ�������ϵ��ת������֪B��D�������г����������л���������˵������ȷ����( )
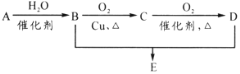
A.75%(�����)��B��Һ������ҽ������
B.D��E������NaOH��Һ��Ӧ
C.��B��D�Ʊ�E����Ũ��������ˮ��
D.B��D��E�������ʿ����ñ���Na2CO3��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ(CH3CHO)���л��ϳ��еĶ�̼�Լ����Ǻϳ����ᡢ�Ҵ�������������ũҩDDT�ȵ�ԭ�ϡ��ش���������:
(1)Andrea Dasic ������ڽ�������M��������N2OΪ����������������ϩ������ȩ������ϵ������ԭѭ����ͼ��ʾ��(��������ԭ�ӵĽ������OA��ʾ)

��ԭ����N����NO�Ľ����OA(N)= 167.4kJ��mol-1,��ԭ������ϩ������ȩ�Ľ����OA(C2 H4)=473 kJmol-1,��������÷�Ӧ�����Ľ���M����ԭ�ӵĽ����OA(M)��ֵӦ����:_______,ʹ�ô�����ʹ�÷�Ӧ�Ļ��____(����������������С��)��
(2)��֪CO(g)��CH4(g)��CH3CHO(l)��ȼ���ȷֱ�Ϊ283.0 kJmol-1��890.31 kJ�� mol-1��1167.9 kJmol-1,����ȩ�ķֽⷴӦCH3CHO(l) ![]() CH4(g)+CO(g)�� H =________��
CH4(g)+CO(g)�� H =________��
(3)��֪:�ں�������I2����Һ��,��ӦCH3CHO(aq) ![]() CH4 (g)+CO(g)����������:
CH4 (g)+CO(g)����������:
��I����ӦΪCH3CHO(aq) +I2(aq)��CH3I(l) + HI(aq) +CO(g)(����Ӧ),��II��Ϊ�췴Ӧ��
����д����II����Ӧ�Ļ�ѧ����ʽ:__________��
������I2��Ũ��______(������"��������")���������ܷ�Ӧ��ƽ������,����Ϊ_________��
(4)��ȩ�����뱥�͵�NaHSO3��Һ������Ӧ����ˮ���Ե�![]() -�ǻ�������:CH3CHO+ NaHSO3
-�ǻ�������:CH3CHO+ NaHSO3![]() CH3CH(OH)SO3Na(
CH3CH(OH)SO3Na(![]() -�ǻ�����Ϊ������ˮ��ǿ��)����Ӧ�ﵽƽ���,��������������,��Ӧ��ϵ�м����������ᣬƽ�⽫___ (���� ��������������������")�ƶ���
-�ǻ�����Ϊ������ˮ��ǿ��)����Ӧ�ﵽƽ���,��������������,��Ӧ��ϵ�м����������ᣬƽ�⽫___ (���� ��������������������")�ƶ���
(5)��100~120 ��C��PdCl2 �C CuCl2����������,��ϩ������O2��Ӧ������ȩ: 2CH2=CH2(g) +O2(g) ![]() 2CH3CHO(g)�� T��Cʱ����2 L�ĺ����ܱ�������ͨ��3 mol CH2=CH2(g)��3 mol O2(g),����������Ӧ,��Ӧ�պôﵽƽ��״̬����ϵѹǿ��Ϊ��ʼѹǿ��5/6����CH2=CH2(g)��ƽ��ת����Ϊ____ (�������3λ��Ч����),T ��Cʱ�÷�Ӧ��ƽ�ⳣ��KΪ________��
2CH3CHO(g)�� T��Cʱ����2 L�ĺ����ܱ�������ͨ��3 mol CH2=CH2(g)��3 mol O2(g),����������Ӧ,��Ӧ�պôﵽƽ��״̬����ϵѹǿ��Ϊ��ʼѹǿ��5/6����CH2=CH2(g)��ƽ��ת����Ϊ____ (�������3λ��Ч����),T ��Cʱ�÷�Ӧ��ƽ�ⳣ��KΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ȼ�ϵ�أ���ͼ��ʾ������˵������ȷ����
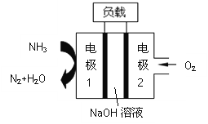
A.�����ĵ缫��ӦʽΪO2+4e��+4H+=2H2O
B.�������缫1���������缫2
C.Na+���������ƶ�
D.NH3�ڵ缫1�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б��������������E�뻯����G��Cr-Ni���¿��Է���ż����Ӧ���ϳ�һ�ֶ�����ŵĻ�����Y����ϳ�·�����£�

��֪����RCN![]() RCOOH
RCOOH
��RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
�ش��������⣺
��1��D�Ľṹ��ʽΪ________��
��2������˵����ȷ����__________��
A.����A�������5��ԭ����ͬһƽ���� B.D����E�ķ�ӦΪȡ����Ӧ
C.����G��������Һ�ܷ�����Ӧ D.����Y�ķ���ʽΪC15H18O3
��3��BΪ���ȴ�������B����C�Ļ�ѧ����ʽΪ_________��
��4��д��ͬʱ��������������D������ͬ���칹��Ľṹ��ʽ_______��
�پ�����ȫ��ͬ�Ĺ����ţ��Ҳ�������O��C��C������
�ں˴Ź���������ʾ���ֲ�ͬ��ѧ�������⣬������֮��Ϊ3��3��2��
��5���Ա��״�����ȩΪԭ���Ʊ�F��д����Ӧ�ĺϳ�·������ͼ(���Լ�����,�ϳ�·������ͼʾ�����������)��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����£���O2����a mol/L FeCl2��Һ�����������ʵ��������ͼ��ʾ��
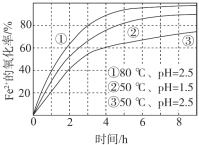
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ��H>0
���з������Ʋ��������
A.�ɢ١��ڿ�֪��pHԽ��Fe2+Խ�ױ�����
B.�ɢڡ����Ʋ⣬��pH��7��Fe2+���ѱ�����
C.pH=2.5��70��ʱ��0~3 h��Fe2+��ƽ������������(Fe2+) < ![]() mol/(L��h)
mol/(L��h)
D.���ߢڵı仯�����Ʋ⣬��Ӧ����ʹ����Һ�¶��½�����Ӧ�����½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ࣨSb���㷺��������������ȼ�����մɡ��뵼��Ԫ����ҽҩ������������
��1������Ԫ�����ڱ��е�λ��_____��
��2���ࣨ�������ﱻ��Ϊ��ף�������SbCl3ˮ���Ƶã���֪SbCl3ˮ������ղ���Ϊ��ס�Ϊ�˵õ��϶ࡢ�ϴ�����ף�����ʱ��SbCl3����������ˮ�У���Ӧ���ڻ�Ҫ����������ˮ�����ñ�Ҫ�Ļ�ѧ�����ƽ���ƶ�ԭ���������������������_______����ҵ�ϣ������û���ȡ��ף��ǽ��������Ҫ�ɷ�ΪSb2S3��װ������¯�������У�����ʹ���ڻ���ͨ���������ַ�Ӧ����ȴ������ס�д������ȡ��Ļ�ѧ����ʽ______��
���Ի����Ϊԭ���Ʊ������࣬����һ�ֹ����������£�
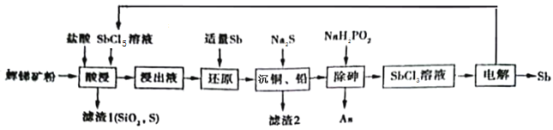
��֪������Ϣ���£�
�ٻ����Sb2S3�⣬�������顢Ǧ��ͭ�Ļ������SiO2�ȣ���
�ڽ���Һ��Ҫ�������SbCl3������SbCl5��CuCl2��AsCl3��PbCl2�����ʣ�
�۳����£�Ksp��CuS��=1.0��10-36��Ksp��PbS��=9.0��10-29��
�ش��������⣺
��3���������������Sb2S3������Ӧ�Ļ�ѧ����ʽΪ_____��
��4����֪������Һ��c��Cu2+��=0.0001mol/L��c�� Pb2+��=0.1mol/L���ڳ���ͭ��Ǧ�����У������μӼ�ϡ��������Һ���Ȳ�����������_____���ѧʽ������CuS��PbS������ʱ��![]() =______������С�����һλ����
=______������С�����һλ����
��5�����������������У���������ΪH3PO4���÷�Ӧ���������뻹ԭ��������ʵ���֮��Ϊ__________��
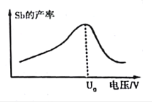
��6����������������У���IJ������ѹ��С��ϵ��ͼ��ʾ������ѹ����U0 Vʱ����IJ��ʽ��͵�ԭ�������_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com