
| A、1mol Na2O和Na2O2的混合物中所含阴离子数为NA |
| B、1.7g H2O2中含有的电子数为0.9NA |
| C、1mol Na2O2与足量的CO2反应,电子转移数为2NA |
| D、标准状况下,2.24L CO2和CO中所含分子数为0.1NA |
| m |
| M |
| V |
| 22.4 |
| 1.7g |
| 34g/mol |
| V |
| 22.4 |
| 2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、苏打-NaHCO3 |
| B、胆矾-CuSO4 |
| C、酒精-CH3OH |
| D、生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L |
| B、0.1mol/L |
| C、0.05mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化剂,KOH是还原剂 |
| B、被还原的氯元素的质量是被氧化的氯元素质量的5倍 |
| C、若反应中消耗12mol KOH,则转移10mol电子 |
| D、将KClO3和KCl的混合物加入到硫酸中反应,不可能产生Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
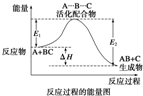
A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫使品红褪色是因为其漂白性,二氧化硫使酸性高锰酸钾褪色也是因为其漂白性 |
| B、CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| C、Fe与Cl2反应产生FeCl3,与硫单质反应产生Fe2S3 |
| D、H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | A | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com