
| 10-14 |
| 0.1 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
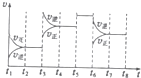 甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.物质 | CH3OCH3(g) | H20(g) | |
| 浓度(mol?L-1) | 0.60 | 0.60 |
| 容器 | 甲2 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCO、4molH2 |
| CH3OH | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
| t1-t2 | t4-t5 | t5-t6 | t7-t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)分析如图所示的四个装置,回答下列问题:
(1)分析如图所示的四个装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| B、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3Na2O2+6H2O═4Fe(OH)3↓+6Na++2Fe3+ |
| C、向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I- |
| D、过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,含有2mol硫酸的浓硫酸与足量的Zn反应,转移的电子数为4NA |
| B、室温下,4.4g乙醛、乙酸乙酯的混合物含有碳原子数为0.2NA |
| C、1.0L1.0mol?L-1Na2CO3溶液中含有的氧原子数为3NA |
| D、在SiO2晶体中1molSi形成的Si-O键为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com