
ЎѕМвДїЎїТСЦЄЈєўЩN2(g)+2O2(g)![]() 2NO2(g) ЎчH=+67.7kJ/mol
2NO2(g) ЎчH=+67.7kJ/mol
ўЪ2N2H4(g)+2O2(g)![]() 2N2(g)+4H2O(g) ЎчH=-1068kJ/mol
2N2(g)+4H2O(g) ЎчH=-1068kJ/mol
ЈЁ1Ј©»рјэ·ўЙдК±їЙУГлВЈЁN2H4Ј©ЧчИјБПЈ¬ТФ¶юСх»ЇµЄЧчСх»ЇјБЈ¬ЛьГЗП໥·ґУ¦ЙъіЙµЄЖшєНЛ®ХфЖшЎЈёщѕЭёЗЛ№¶ЁВЙРґіцN2H 4єНNO2·ґУ¦µДИИ»ЇС§·ЅіМКЅОЄ____Ј»
ЈЁ2Ј©лВЈЁN2H4Ј©єНСхЖш·ґУ¦µДДЬБї±д»ЇИзНјЛщКѕЈ¬НјЦРE1±нКѕ___Ј¬E2±нКѕ____Ј¬ЎчH=-534kJ/mol±нКѕ_____ЎЈ

Ўѕґр°ёЎї2N2H4(g)+2NO2(g)![]() 3N2(g)+4H2O(g) ЎчH=-1135.7kJ/mol Хэ·ґУ¦µД»о»ЇДЬ Дж·ґУ¦µД»о»ЇДЬ лВЈЁN2H4Ј©µДИјЙХИИ
3N2(g)+4H2O(g) ЎчH=-1135.7kJ/mol Хэ·ґУ¦µД»о»ЇДЬ Дж·ґУ¦µД»о»ЇДЬ лВЈЁN2H4Ј©µДИјЙХИИ
ЎѕЅвОцЎї
ЈЁ1Ј©ТСЦЄЈєўЩЎўN2(g)+2O2(g)![]() 2NO2(g) ЎчH=+67.7kJ/molЈ»
2NO2(g) ЎчH=+67.7kJ/molЈ»
ўЪ2N2H4(g)+2O2(g)![]() 2N2(g)+4H2O(g) ЎчH=-1068kJ/molЈ»
2N2(g)+4H2O(g) ЎчH=-1068kJ/molЈ»
УЙёЗЛ№¶ЁВЙЈ¬ўЪ-ўЩµГ2N2H4(g)+2NO2(g)![]() 3N2(g)+4H2O(g)Ј¬
3N2(g)+4H2O(g)Ј¬
№КёГ·ґУ¦µДЎчH=-1068kJmol-1-67.7kJmol-1=-1135.7 kJmol-1Ј¬
јґ2N2H4(g)+2NO2(g)![]() 3N2(g)+4H2O(g) ЎчH=-1135.7kJ/molЈ»
3N2(g)+4H2O(g) ЎчH=-1135.7kJ/molЈ»
ЈЁ2Ј©лВЈЁN2H4Ј©єНСхЖш·ґУ¦µДДЬБї±д»ЇИзНјЛщКѕЈ¬НјЦРE1±нКѕХэ·ґУ¦µД»о»ЇДЬЈ¬E2±нКѕДж·ґУ¦µД»о»ЇДЬЈ¬ЎчH=-534kJ/mol±нКѕлВЈЁN2H4Ј©µДИјЙХИИЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪТ»¶ЁМхјюПВЈ¬їЙДж·ґУ¦AЈ«B![]() mC±д»ЇИзНјЛщКѕЎЈТСЦЄЧЭЧш±к±нКѕФЪІ»Н¬ОВ¶ИєНС№ЗїПВЙъіЙОпCФЪ»мєПОпЦРµДЦКБї·ЦКэЈ¬pОЄ·ґУ¦ФЪT2ОВ¶ИК±ґпµЅЖЅєвєуПтИЭЖчјУС№µД±д»ЇЗйїцЈ¬ОКЈє
mC±д»ЇИзНјЛщКѕЎЈТСЦЄЧЭЧш±к±нКѕФЪІ»Н¬ОВ¶ИєНС№ЗїПВЙъіЙОпCФЪ»мєПОпЦРµДЦКБї·ЦКэЈ¬pОЄ·ґУ¦ФЪT2ОВ¶ИК±ґпµЅЖЅєвєуПтИЭЖчјУС№µД±д»ЇЗйїцЈ¬ОКЈє
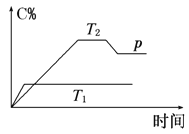
ЈЁ1Ј©ОВ¶ИT1________T2(МоЎ°ґуУЪЎ±Ў°µИУЪЎ±»тЎ°РЎУЪЎ±)ЎЈ
ЈЁ2Ј©Хэ·ґУ¦КЗ________·ґУ¦(МоЎ°ОьИИЎ±»тЎ°·ЕИИЎ±)ЎЈ
ЈЁ3Ј©Из№ыAЎўBЎўCѕщОЄЖшМеЈ¬Фтm________2(МоЎ°ґуУЪЎ±Ў°µИУЪЎ±»тЎ°РЎУЪЎ±)ЎЈ
ЈЁ4Ј©µ±ОВ¶ИєНИЭ»эІ»±дК±Ј¬ИзФЪЖЅєвМеПµЦРјУИлТ»¶ЁБїµДДіПЎУРЖшМеЈ¬ФтМеПµµДС№Зї________(МоЎ°ФцґуЎ±Ў°јхРЎЎ±»тЎ°І»±дЎ±)Ј¬ЖЅєв___ _____ТЖ¶Ї(МоЎ°ПтХэ·ґУ¦·ЅПтЎ±Ў°ПтДж·ґУ¦·ЅПтЎ±»тЎ°І»Ў±)ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЛ®µДµзАлЖЅєвЗъПЯИзНјЛщКѕЈ¬ПВБРЛµ·ЁХэИ·µДКЗ
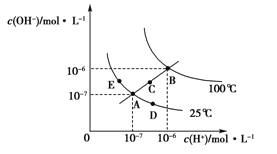
A. НјЦРОеµгKWјдµД№ШПµЈєB>C>AЈЅDЈЅE
B. ИфґУAµгµЅDµгЈ¬їЙІЙУГФЪЛ®ЦРјУИлЙЩБїNaOHµД·Ѕ·Ё
C. ИфґУAµгµЅCµгЈ¬їЙІЙУГОВ¶ИІ»±дК±ФЪЛ®ЦРјУИлККБїH2SO4 µД·Ѕ·Ё
D. Ифґ¦ФЪBµгК±Ј¬Ѕ«pHЈЅ2µДБтЛбУлpHЈЅ12µДKOHµИМе»э»мєПєуЈ¬ИЬТєПФЦРРФ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЛбЎўјоЎўСО¶јКЗµзЅвЦКЈ¬ФЪЛ®ЦР¶јДЬµзАліцАлЧУЎЈёщѕЭПВБР»ЇєПОпЈєўЩNaOH ўЪCH3COOH ўЫNH4Cl ўЬNH3Ў¤H2O ўЭCH3COONa,Зл»ШґрПВБРОКМвЈє
(1)ЙПКцјёЦЦµзЅвЦКЦРКфУЪИхµзЅвЦКµДКЗ______________
(2)іЈОВПВpH=2µДCH3COOHИЬТєЦРУЙЛ®µзАлІъЙъµД c(OHЈ) =_____________________
(3)РґіцCH3COOHµДµзАл·ЅіМКЅ_______________________
(4)Ѕ«µИpHµИМе»эµДNaOHєНNH3Ў¤H2O·Ц±рПЎКНm±¶єНn±¶Ј¬ПЎКНєуБЅИЬТєµДpHИФПаµИЈ¬Фтm ___________n ЈЁМоЎ°ґуУЪЎўµИУЪ»тРЎУЪЎ±Ј©
(5)pHЈЅ12µДNaOHИЬТє100mLЈ¬ТЄК№ЛьµДpHОЄ11Ј¬Из№ыјУ0.01mol/L HClЈ¬У¦јУ_______mLЎЈЈЁМе»э±д»ЇєцВФІ»јЖЈ©
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪ25ЎжК±Ј¬УГХфБуЛ®ПЎКН1molЎ¤L-1µД°±Л®ЦБ0.01molЎ¤L-1Ј¬ЛжЧЕИЬТєµДПЎКНЈ¬ПВБРёчПо±ИЦµЦРКјЦХІ»±дµДКЗЈЁ Ј©
A.![]() B.
B.![]()
C.![]() D.
D.![]()
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіКµСйРЎЧйЙијЖУГ50mL1.0 mol/LСОЛбёъ50mL1.1mol/LЗвСх»ЇДЖИЬТєФЪИзНјЧ°ЦГЦРЅшРРЦРєН·ґУ¦ЎЈФЪґуЙХ±µЧІїµжЕЭДЛЬБПЈЁ»тЦЅМхЈ©Ј¬К№·ЕИлµДРЎЙХ±±їЪУлґуЙХ±±їЪПаЖЅЎЈИ»єуФЩФЪґуЎўРЎЙХ±Ц®јдМоВъЛйЕЭДЛЬБПЈЁ»тЦЅМхЈ©Ј¬ґуЙХ±ЙПУГЕЭДЛЬБП°еЈЁ»тУІЦЅ°еЈ©ЧчёЗ°еЈ¬ФЪ°еЦРјдїЄБЅёцРЎїЧЈ¬ХэєГК№ОВ¶ИјЖєН»·РОІЈБ§ЅБ°и°фНЁ№эЎЈНЁ№эІв¶Ё·ґУ¦№эіМЦРЛщ·ЕіцµДИИБїїЙјЖЛгЦРєНИИЎЈКФ»ШґрПВБРОКМвЈє
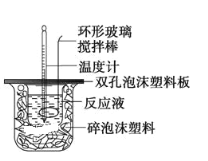
ЈЁ1Ј©±ѕКµСйЦРУГЙФ№эБїµДNaOHµДФТтЅМІДЦРЛµКЗОЄ±ЈЦ¤СОЛбНкИ«±»ЦРєНЎЈКФОКЈєСОЛбФЪ·ґУ¦ЦРИфТтОЄУР·ЕИИПЦП󣬶шФміЙЙЩБїСОЛбФЪ·ґУ¦ЦР»У·ўЈ¬ФтІвµГµДЦРєНИИ___ЈЁМоЎ°Ж«ґуЎ±Ў°Ж«РЎЎ±»тЎ°І»±дЎ±Ј©ЎЈ
ЈЁ2Ј©ёГКµСйРЎЧйЧцБЛИэґОКµСйЈ¬ГїґОИЎИЬТєёч50 mLЈ¬ІўјЗВјИзПВФКјКэѕЭЎЈ
КµСйРтєЕ | ЖрКјОВ¶Иt1/Ўж | ЦХЦ№ОВ¶Иt2/Ўж | ОВІо(t2-t1)/Ўж | ||
СОЛб | NaOHИЬТє | ЖЅѕщЦµ | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
ТСЦЄСОЛбЎўNaOHИЬТєГЬ¶ИЅьЛЖОЄ1.00g/cm3Ј¬ЦРєНєу»мєПТєµД±ИИИИЭc=4.18ЎБ10-3 kJ/(gЎ¤Ўж)Ј¬»мєПєуИЬТєЦКБїОЄmЈ¬·ґУ¦·ЕіцµДИИБїQ=cmЎчtЈ¬ФтёГ·ґУ¦ЙъіЙЛ®µДОпЦКµДБїОЄ____Ј¬ЦРєНИИОЄ¦¤H=____ЎЈ
ЈЁ3Ј©ИфУГµИЕЁ¶ИµДСОЛбУлNH3Ў¤H2OИЬТє·ґУ¦Ј¬ФтІвµГµДЦРєНИИ»б___ЈЁМоЎ°Ж«ґуЎ±Ў°Ж«РЎЎ±»тЎ°І»±дЎ±Ј©Ј¬ЖдФТтКЗ____ЎЈ
ЈЁ4Ј©ФЪЦРєНИИІв¶ЁКµСйЦРґжФЪУГЛ®ПґµУОВ¶ИјЖЙПµДСОЛбИЬТєµДІЅЦиЈ¬ИфОЮґЛІЩЧчІЅЦиЈ¬ФтІвµГµДЦРєНИИ____ЈЁМоЎ°Ж«ґуЎ±Ў°Ж«РЎЎ±»тЎ°І»±дЎ±Ј©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї¶ФУЪ·ґУ¦3Fe(s)Ј«4H2O(g)![]() Fe3O4(s)Ј«4H2(g)µДЖЅєвіЈКэЈ¬ПВБРЛµ·ЁХэИ·µДКЗ
Fe3O4(s)Ј«4H2(g)µДЖЅєвіЈКэЈ¬ПВБРЛµ·ЁХэИ·µДКЗ
A. KЈЅ![]()
B. KЈЅ![]()
C. Фцґуc(H2O)»тјхРЎc(H2)Ј¬»бК№ёГ·ґУ¦ЖЅєвіЈКэјхРЎ
D. ёД±д·ґУ¦µДОВ¶ИЈ¬ЖЅєвіЈКэІ»Т»¶Ё±д»Ї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪєгОВєгИЭµДГЬ±ХИЭЖчЦРЈ¬·ўЙъїЙДж·ґУ¦2NO(g)+O2(g)![]() 2NO2(g)Ј¬І»ДЬЛµГчёГ·ґУ¦ТСѕґпµЅЖЅєвЧґМ¬µДКЗ
2NO2(g)Ј¬І»ДЬЛµГчёГ·ґУ¦ТСѕґпµЅЖЅєвЧґМ¬µДКЗ
A. Хэ·ґУ¦ЙъіЙNO2µДЛЩВКєНДж·ґУ¦ЙъіЙNOµДЛЩВКПаµИ
B. ·ґУ¦ИЭЖчЦРС№ЗїІ»ЛжК±јдµДСУі¤¶ш±д»Ї
C. »мєПЖшМеСХЙ«ЙоЗі±ЈіЦІ»±д
D. »мєПЖшМеµДГЬ¶ИІ»ЛжК±јдСУі¤¶ш±д»Ї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїёщѕЭИзПВДЬБї№ШПµКѕТвНј·ЦОцЈ¬ПВБРЛµ·ЁХэИ·µДКЗ

A. 1molC(g)Ул1molO2(g)µДДЬБїЦ®єНОЄ393.5kJ
B. ·ґУ¦2CO(g)+O2(g)=2CO2(g)ЦРЈ¬·ґУ¦ОпµДЧЬјьДЬРЎУЪЙъіЙОпµДЧЬјьДЬ
C. CЎъCOµДИИ»ЇС§·ЅіМКЅОЄ2C(s) +O2(g)=2CO(g) ЎчH=-110.6kJ/mol
D. ИИЦµКЗЦёТ»¶ЁМхјюПВµҐО»ЦКБїµДОпЦКНкИ«ИјЙХЛщ·ЕіцµДИИБїЈ¬ФтCOµДИИЦµЎчH=10.1kJ/g
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com