
【题目】人类对锡(50Sn)的使用有悠久的历史,可以追溯到大约公元前3000年,但这也是对锡的“异常”不断加深认识,不断“驯服”它的历史。
(1)锡与硅同主族,稳定化合价均为+4价,锡原子比硅原子核外多2个电子层,锡元素在周期表中的位置为___________________。
(2)锡单质在常温下稳定(主要单质类别为白锡),但是它既怕冷又怕热。在-13.2℃以下,白锡转变成一种无定形的灰锡(粉末状),而且只要白锡接触到很少的灰锡。很失就会变成灰锡完全毁坏,就像得了瘟疫一样。
①克服锡单质这一弱点的方法之一就是做成合金,合金与组分金属相比一般具有____性质。
a.不导电 b硬度大 c.耐腐蚀
②对锡器的“瘟疫”作分析,以下推测合理的是_________________。
a.灰锡携带病毒
b.灰锡与白锡形成原电池,加速白锡的转化
c.灰锡是白锡转化的催化剂,加速反应
(3)实验室配制氯化亚锡(SnCl2)溶液时发现,向SnCl2固体中加水的过程中,产生刺激性气味气体,且只能得到悬浊液。配制、保存SnCl2溶液时,要用到的试剂为氯化亚锡固体、__________、______________和水(填试剂名称)。
(4)工业上,硫离子是一种很好的沉淀剂。但向1L 0.01 mol·L-1硫化钠溶液(pH=12)中逐渐加入SnCl2粉末时,一开始却并没观察至沉淀。请分析原因_________________。当加SnCl2至溶液pH=9时,有两种沉淀生成。此时溶液中硫离子浓度为__________(保留两位有效数字)。(提示:25℃时,Ksp[Sn(OH)2]=1.4×10-28,Ksp(SnS)=1.0×10-25。 Sn(OH)2 是两性物质。)
(5)测定固体中锡的含量时,常用的一种方法为:在强酸性环境中将固体溶解,然后将锡元素全部转化成Sn2+,以淀粉为指示剂,用碘酸钾标准溶液滴定。但在滴定初始并没有出现蓝色,滴定终点的现象为无色变蓝色。写出滴定过程中依次发生反应的离子反应方程式_______________,______________。
【答案】 第五周期 第ⅣA族 b c 浓盐酸 锡 开始时,生成沉淀Sn(OH)2所需Sn2+浓度为1.4×10-24mol/L,而生成沉淀SnS所需Sn2+浓度为1.0×l0-23mol/L,Sn(OH)2优先沉淀,但Sn(OH)2+2OH-=SnO22-+2H2O,所以一开始未生成沉淀 7.1×10-8mol/L 3Sn2++IO3-+6H+=3Sn4++I-+3H2O 5I-+ IO3-+6H+=3I2+3H2O
【解析】分析:本题是一道无机综合题,考查元素周期表,离子方程式书写,溶度积等,难度较大。
详解:(1)由信息锡与硅同主族,稳定化合价均为+4价,锡原子比硅原子核外多2个电子层,硅在第三周期第ⅣA族,则锡元素在第五周期第ⅣA族。故答案为:第五周期 第ⅣA族。
(2)①合金是金属与金属或非金属融合而成的具有金属特性的混合物,与组分金属相比具有一些优良性能,如密度小硬度大等,因此本题正确答案选b。
②通过信息:只要白锡接触到很少的灰锡,很失就会变成灰锡完全毁坏,可见灰锡是白锡转化的催化剂,加速反应,故本题正确答案选c。
(3)SnCl2易水解生成碱式氯化亚锡,存在平衡SnCl2+H2O![]() Sn(OH)Cl+HCl,加入盐酸,使平衡向左移动,抑制水解,加入Sn防止Sn2+被氧化,所以用到的试剂为氯化亚锡固体、浓盐酸、锡和水,故本题正确答案:浓盐酸; 锡;
Sn(OH)Cl+HCl,加入盐酸,使平衡向左移动,抑制水解,加入Sn防止Sn2+被氧化,所以用到的试剂为氯化亚锡固体、浓盐酸、锡和水,故本题正确答案:浓盐酸; 锡;
(4)Ksp[Sn(OH)2]=1.4×10-28,Ksp(SnS)=1.0×10-25,开始时,c(S2-)=0.01mol·L-1,c(OH-)=0.01mol·L-1,生成沉淀Sn(OH)2所需Sn2+浓度=![]() mol/L=1.4×10-24mol/L,而生成沉淀SnS所需Sn2+浓度=1.0×10-25/0.01mol/L=1.0×l0-23mol/L,Sn(OH)2优先沉淀,但Sn(OH)2+2OH-=SnO22-+2H2O,所以一开始未生成沉淀;当加SnCl2至溶液pH=9时,c(OH-)=1.0×10-5mol·L-1,,c(Sn2+)=
mol/L=1.4×10-24mol/L,而生成沉淀SnS所需Sn2+浓度=1.0×10-25/0.01mol/L=1.0×l0-23mol/L,Sn(OH)2优先沉淀,但Sn(OH)2+2OH-=SnO22-+2H2O,所以一开始未生成沉淀;当加SnCl2至溶液pH=9时,c(OH-)=1.0×10-5mol·L-1,,c(Sn2+)=![]() mol·L-1 =1.4×10-23mol/L,c(S2-)=1.0×10-25/1.4×10-23mol/L=7.1×10-8mol/L
mol·L-1 =1.4×10-23mol/L,c(S2-)=1.0×10-25/1.4×10-23mol/L=7.1×10-8mol/L
(5)滴定过程中先发生IO3-在强酸性环境中将Sn2+氧化为Sn4+,本身被还原为I-,I-和IO3-在酸性条件下发生反应生成碘单质,根据电子守恒、电荷守恒及原子守恒写出离子反应方程式为: 3Sn2++IO3-+6H+=3Sn4++I-+3H2O、 5I-+ IO3-+6H+=3I2+3H2O,所以本题正确答案为:3Sn2++IO3-+6H+=3Sn4++I-+3H2O ; 5I-+ IO3-+6H+=3I2+3H2O。


科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
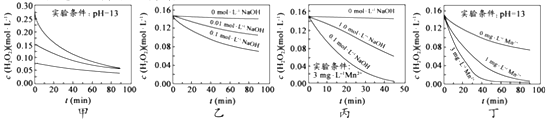
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体中结晶水含量的实验中,错误的操作是
A. 要进行恒重操作
B. 在空气中冷却后再称量
C. 加热后不能趁热称量
D. 在加热硫酸铜晶体时,要慢慢加热至晶体全部变成白色粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+![]() Cr3++Fe3++H2O ②,下列有关说法正确的是
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体质量减轻的是( ) ①氨气通过灼热的CuO粉末
②二氧化碳通过Na2O2粉末
③水蒸气通过灼热的Fe粉
④Zn投入CuSO4溶液.
A.①②
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和Ag2O都属于盐B.Ba(OH)2和Na2CO3都属于碱
C.Na2O2和CaO都属于氧化物D.H2SO4和CH3COONH4都属于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.K2SO4=2K+ +SO4-2B.Ba(OH)2=Ba2+ +OH-2
C.Mg(NO3)2=Mg 2++2(NO3)2D.Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1 mol能与2 mol HCl加成,所得的加成产物每摩尔又能与8 mol Cl2反应,最后得到一种只含C、Cl两种元素的化合物,则气态烃为( )
A. 丙烯B. 丁烯
C. 1-丁炔D. 2-甲基-1,3-丁二烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com