
【题目】测定硫酸铜晶体中结晶水含量的实验中,错误的操作是
A. 要进行恒重操作
B. 在空气中冷却后再称量
C. 加热后不能趁热称量
D. 在加热硫酸铜晶体时,要慢慢加热至晶体全部变成白色粉末
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是( )
A.溶液呈电中性,而胶体可以带电荷
B.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀
C.某纳米材料微粒直径为30nm,因此该纳米材料属于胶体
D.往Fe(OH)3胶体中逐滴加入稀硫酸会产生先沉淀而后沉淀逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因__________。
(2)基态氮原子中,核外电子占据的最高能层的符号为_______,核外电子能量最高的电子的电子云轮廓图形状为_________。
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为__________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如N5AsF6中存在高能量的N5+,N5+的空间构型为_______。(每个N原子都满足8电子稳定结构)
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中画出其晶胞_____,并写出该化合物的化学式_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是
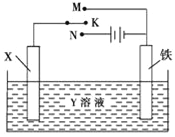
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对锡(50Sn)的使用有悠久的历史,可以追溯到大约公元前3000年,但这也是对锡的“异常”不断加深认识,不断“驯服”它的历史。
(1)锡与硅同主族,稳定化合价均为+4价,锡原子比硅原子核外多2个电子层,锡元素在周期表中的位置为___________________。
(2)锡单质在常温下稳定(主要单质类别为白锡),但是它既怕冷又怕热。在-13.2℃以下,白锡转变成一种无定形的灰锡(粉末状),而且只要白锡接触到很少的灰锡。很失就会变成灰锡完全毁坏,就像得了瘟疫一样。
①克服锡单质这一弱点的方法之一就是做成合金,合金与组分金属相比一般具有____性质。
a.不导电 b硬度大 c.耐腐蚀
②对锡器的“瘟疫”作分析,以下推测合理的是_________________。
a.灰锡携带病毒
b.灰锡与白锡形成原电池,加速白锡的转化
c.灰锡是白锡转化的催化剂,加速反应
(3)实验室配制氯化亚锡(SnCl2)溶液时发现,向SnCl2固体中加水的过程中,产生刺激性气味气体,且只能得到悬浊液。配制、保存SnCl2溶液时,要用到的试剂为氯化亚锡固体、__________、______________和水(填试剂名称)。
(4)工业上,硫离子是一种很好的沉淀剂。但向1L 0.01 mol·L-1硫化钠溶液(pH=12)中逐渐加入SnCl2粉末时,一开始却并没观察至沉淀。请分析原因_________________。当加SnCl2至溶液pH=9时,有两种沉淀生成。此时溶液中硫离子浓度为__________(保留两位有效数字)。(提示:25℃时,Ksp[Sn(OH)2]=1.4×10-28,Ksp(SnS)=1.0×10-25。 Sn(OH)2 是两性物质。)
(5)测定固体中锡的含量时,常用的一种方法为:在强酸性环境中将固体溶解,然后将锡元素全部转化成Sn2+,以淀粉为指示剂,用碘酸钾标准溶液滴定。但在滴定初始并没有出现蓝色,滴定终点的现象为无色变蓝色。写出滴定过程中依次发生反应的离子反应方程式_______________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为____个,能量最高的电子占据的能级符号为__。
(2)磷的一种同素异形体—白磷(P4)的立体构型为____,推测其在CS2中的溶解度____(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____,已知晶体的密度为pg·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含p、NA的式子表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com