
����Ŀ���������ƣ�NaNO2����ۿ���ʳ��������ζ����һ�ֳ��õķ�ɫ���ͷ�������ʹ�ù�����ʹ���ж���ij��ȤС���������ʵ��̽������������֪����
��HNO2Ϊ���ᣬ
��2NO+Na2O2=2NaNO2��
��2NO2+Na2O2=2NaNO3
������KMnO4��Һ�ɽ�NO��NO2��������ΪNO3����MnO4����ԭ��Mn2+��
NaNO2���Ʊ�������������2�ַ������г�װ�úͼ���װ�����ԣ��������Ѽ��飩��
�Ʊ�װ��1��
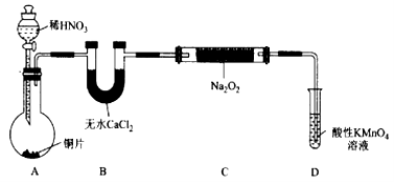
�Ʊ�װ��2��
��1�����Ʊ�װ��1�У�
�� ���û��Bװ�ã�C�з����ĸ���Ӧ�� ��
�� ��ͬѧ�����װ�����������ú����ʵ�飬�����Ƶõ�NaNO2�л��н϶��NaNO3���ʣ�������Aװ����Bװ�ü������� װ�ã��Ľ��������NaNO2�Ĵ��ȣ�
�� Dװ�÷�����Ӧ�����ӷ���ʽΪ ��
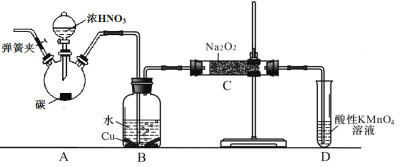
��2�����Ʊ�װ��2�У�
�� Bװ�õ������� ��
�� д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���õ����ű�����ӵ�ת�� ��
�� Ϊ����B���ݳ��������л��е�����������Na2O2��Ӧ��Ӧ��B��Cװ�ü�����һ��װ�ã����װ����ʢ�ŵ�ҩƷ����Ϊ ��
�� ʵ�龭�Ľ�����Ƶýϴ��������ƣ����й����������Ƶ�˵����ȷ����________��
a.������������ζ���ɴ���ʳ��ʳ��
b.�����£�0.1mol/L����������ҺpH>1
c.0.1mol/L����������Һ�д��ڣ�c(Na+)+c(H+)=c(NO2-)+c(OH-)
d.0.1mol/L����������Һ�д��ڣ�c(NO2-)>c(Na+)>c(OH-)>c(H+)
�� �����ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ� ��
���𰸡���1����2Na2O2+2H2O=4NaOH+O2����2NO+O2=NO2
��װ��ˮ��ϴ��ƿ
��5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
��2������ȡNO����NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO��
��![]()
�ۼ�ʯ�ң�����ʯ�һ�NaOH��
��bc
��ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬������ϡ�����ữ�����μ���1-2�Σ�����������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2��
��������
�����������1��������ͭ��ϡ�����Ƶõ�һ�������к���ˮ��ˮ��������Ʒ�����Ӧ����������������NO����ΪNO2�����û��Bװ�ã�C�з����ĸ���Ӧ��2Na2O2 + 2H2O = 4NaOH + O2����2NO + O2 = NO2��
�����ڻ��һ���������õ�������лӷ��ԣ����������ʵ������������A��B֮������װ��ˮ��ϴ��ƿ��
��������ؾ��������ԣ��ܽ�һ������������Dװ�÷�����Ӧ�����ӷ���ʽΪ5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O��
��2���� ̼��Ũ���ᷴӦ����CO2��NO2��H2O�� Bװ�õ���������NO2ת��ΪNO����̼��Ũ���ᷴӦ����CO2��NO2��H2O�Ļ�ѧ����ʽ���õ����ű�����ӵ�ת��![]() ��B���ݳ��������л��е�����������CO2��H2O��Ӧ��B��Cװ�ü�����һ��װ�ã�����CO2��H2O����װ����ʢ�ŵ�ҩƷ����Ϊ��ʯ����
��B���ݳ��������л��е�����������CO2��H2O��Ӧ��B��Cװ�ü�����һ��װ�ã�����CO2��H2O����װ����ʢ�ŵ�ҩƷ����Ϊ��ʯ����
��a. �������ж����ɴ���ʳ��ʳ����a����
b.�����£�����������ǿ�������Σ��ʼ��ԣ�0.1 mol/L����������ҺpH > 7��b��ȷ��
c.���ݵ���غ㣬 0.1 mol/L����������Һ�д��ڣ�c(Na+) + c(H+) = c(NO2- ) + c(OH- )��c��ȷ��
d.����������ǿ�������Σ�0.1 mol/L����������Һ�д��ڣ�c(Na+) >c(NO2- ) > c(OH- ) > c(H+)��d����
����������KMnO4��Һ�ɽ�NO2��������ΪNO3��������װ��C��NaNO2�Ĵ����ķ�����ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ� ��������ϡ�����ữ�����μ���1-2�Σ�����������KMnO4��Һ ������Һ��ɫ��ȥ ��˵��C�в��ﺬ��NaNO2��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ����ȡ������Ϊ50 mL �� A��B ����NaOH ��Һ�У��ֱ�ͨ��һ������CO2����ϡ�͵�100 mL��
(1)�� NaOH ��Һ��ͨ��һ������ CO2 ����Һ�����ʵĿ��������
��_________�� ��________�� ��________�� ��________��
(2)��ϡ�ͺ����Һ����μ���0.2 mol/L �����ᣬ���� CO2 �����(��״��)����������������ϵ��ͼ��ʾ��
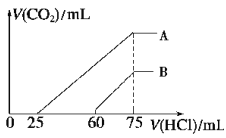
��A ���߱�����ԭ��Һͨ��CO2���������������ᷴӦ���� CO2 ����������_____mL(��״��)��
��B ���߱�����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪ______________��
��ԭ NaOH ��Һ�����ʵ���Ũ��Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H7Cl���л����ṹ��������
A��ֻ��һ��˫����ֱ���л��� B����������˫����ֱ���л���
C������һ��˫���Ļ�״�л��� D������һ��������ֱ���л���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ωһ������֢�Ķ����ѧ�о��������������ں���һ�ֽ���ϩ,���п����ԡ���֪��ϩ���Ӻ���30��Cԭ�Ӽ�6��C=C�Ҳ�����״�ṹ,�������ʽΪ
A��C30H48 B��C30H50 C�� C30H60 D��C30H62
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ������ ��
A��������������ϡ���FeO+2H+=Fe2++H2O
B��NaHCO3��Һ�м�����Ba(OH)2��Һ��HCO3����Ba2����OH��=BaCO3����H2O
C����FeBr2��Һ��ͨ������Cl2��2Fe2++2Br��+2Cl2=2Fe3++4Cl��+Br2
D����������ˮ��Cl2��H2O![]() 2H����Cl����ClO��
2H����Cl����ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ȫʵ�飬�������ð����� ��
A.����Һ��
B.�ȿ�����
C.��������ˮ
D.�ܸ�ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���е����ʾ�������Ի�������ʽ���ڣ�Ϊ�˱����о������ã�����Ի������з�����ᴿ������A��B��C��D����ѧ�����Ļ���������ᴿ��װ�á�

I������ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D �����ʵ��Ŀո��С�
��1��̼�������Һ�з����̼���__________________��
��2���Ȼ�����Һ�з�����Ȼ���____________________��
��3������ֲ���ͺ�ˮ____________________��
��4������ƾ���ˮ____________________��
��5���Ȼ�����Һ�з����ˮ____________________��
II����ˮ����ȡ�ⵥ�ʵķ������£�
��1����ȡ��Һ
�����п���Ϊ��ˮ����ȡ�ⵥ����ȡ������__________
A���ƾ� B����
����Һ©����ʹ��ǰ������________________��
�������ϵ�֪���ѣ�H2O��>�ѣ�����>�ѣ��ƾ���������������ѡ��ȡ����ȡ��ˮ�еĵⵥ�ʣ���Һʱ��ˮ��Ӧ�ɷ�Һ©����_______�˿ڷų����л���Ӧ�ɷ�Һ©����________�˿ڷų���������ϡ����ߡ��¡��� ��
��2������
������װ��������ˮӦ��_______�ڽ�����ϡ����¡���
����֪������Ȼ�̼���۷е�����������
�۵� | �е� | |
�� | 113.7�� | 184.3�� |
���Ȼ�̼ | -22.6�� | 76.8�� |
���������������Ȼ�̼�Ļ�����ƿ�����ռ��������ʵ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȱ������������ֱ��������Ե��ǣ� ��
A.C+ŨHNO3
B.Cu+ϡHNO3
C.CuO+ŨHNO3
D.NaOH+HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ����
A��ͭ����������Һ��Ӧ��Cu��Ag��= Cu2����Ag
B��С�մ���Һ��ϡ�����ϣ�CO![]() ��2H��= CO2����H2O
��2H��= CO2����H2O
C������ʯ�ܽ��ڴ��CaCO3��2H��= Ca2����CO2����H2O
D��CuSO4��Һ��Ba(OH)2��Һ��ϣ�Cu2����SO![]() ��Ba2����2OH��=BaSO4����Cu(OH)2��
��Ba2����2OH��=BaSO4����Cu(OH)2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com