
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
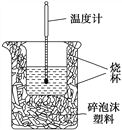
(1)该图中有两处未画出,它们是__________、__________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中所测出的“中和热”将______(填“偏大”“偏小”或“不变”);原因是_________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)取50mL 0.5mol/LNaOH溶液和30mL 0.5mol/L硫酸进行实验,实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.1 | 26.3 | 26.2 | 30.5 | |
2 | 27.0 | 27.4 | 27.2 | 34.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.0 | |
酸碱溶液的密度均近似为1g/mL,中和后溶液的比热容c =4.18J/(g·℃)。则根据表中数据计算中和热△H 为_________________
(6)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L -130 mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
【答案】 环形玻璃搅拌棒 烧杯上方的泡沫塑料板或硬纸板 提高装置的保温效果 偏大 固体NaOH溶于水放热 ΔH1=ΔH2<ΔH3 -56.2kJ/mol b
【解析】(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,为了减少热量的损失,烧杯上方盖硬纸板;故答案为:环形玻璃搅拌棒;烧杯上方盖硬纸板;
(2)在中和反应中,必须确保热量不散失;故答案为:提高装置的保温效果;
(3)氢氧化钠固体溶于水放热,所以实验中测得的“中和热”数值将偏大,故答案为:偏大;氢氧化钠固体溶于水放热;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1molL-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1molL-1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H1=△H2<△H3;故答案为:△H1=△H2<△H3;
(5)50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=80g,3次实验的温度变化分别为:4.3℃,7.1℃,4.1℃,第二次实验误差较大,删除,△T=4.2℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×4.2℃=1404.48J,所以实验测得的中和热△H=-![]() =-56.2kJ/mol,故答案为:-56.2kJ/mol;
=-56.2kJ/mol,故答案为:-56.2kJ/mol;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;故答案为:b。


科目:高中化学 来源: 题型:
【题目】下列有关胶体及分散系的说法正确的是
A. 胶体粒子直径大于100 nm
B. 丁达尔效应可以用于检验胶体
C. 将FeCl3溶液滴加到氢氧化钠浓溶液中即可制得氢氧化铁胶体
D. 分离胶体和溶液可以采用过滤的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列有关化学与生活、生产和技术的说法中,不正确的是
A. 医疗上常用75%的酒精进行消毒
B. 光导纤维的主要成份是二氧化硅
C. 食品行业用小苏打制作发酵粉
D. SO2可以随意排放,对环境没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O的说法不正确的是
A. 该反应中,KMnO4是还原剂
B. 该反应中,C元素被氧化
C. 通过该反应可知,氧化性: KMnO4> CO2
D. 该反应每转移1mol电子,同时生成1molCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将浓度为0.1mol/L的盐酸逐滴加入到20mL 0.1mol/L一元碱MOH溶液中,溶液的pH随盐酸体积的变化如图所示。下列说法正确的是
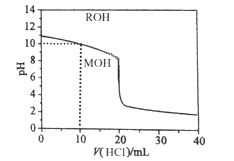
A. pH=10时,c(Cl-)>c(M+)>c(OH-)>c(H+)
B. V(HCl)=20mL,MOH与盐酸反应后的溶液显酸性
C. 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内的含量虽然很少,但在维持正常生命活动中不可缺少。这种说法可通过下面的哪一实例得到证实( )
A.植物缺镁时叶片变黄
B.油菜缺硼时只开花不结果
C.动物血液中钙盐的含量太低,容易发生抽搐
D.缺磷时会影响ATP的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com