
【题目】某化学兴趣小组,欲在常温常压下,用一定质量的铜镁合金与足量稀盐酸反应,利用图装置,测定样品中铜的质量分数.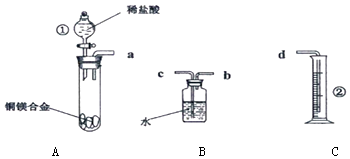
(1)实验反应原理:写出A中发生反应的离子方程式 .
(2)仪器识别:写出上图中仪器①的名称 .
(3)实验中,该兴趣小组同学测得以下数据
a.反应前样品铜镁合金的质量,记为m1 g
b.反应结束后,经过处理后的残余固体的质量,记为m2 g
c.经过一系列正确的操作后,读取量筒中的水的体积,记为V mL
d.查阅资料,常温常压下,H2的密度为ρ g/L
四位同学分成甲、乙两个小组,甲组同学利用重量法为思路,请合理选择以上数据,列式求铜的质量分数:×100%;乙组同学利用排水法测量气体体积为思路,请合理选择以上数据,列式求铜的质量分数:×100%
(4)误差分析环节中指导教师提出,甲、乙两组同学的思路中,会有很多因素导致测得的铜的质量分数出现误差,现将可能导致误差的因素罗列如下,回答相关问题:
a.读取量筒中水的体积时,未等装置中气体恢复至室温
b.未考虑B、C装置间连接导管中残留的水
c.未对反应后剩余的残余物进行洗涤
d.未对反应中挥发出的HCl气体进行除杂处理
导致铜的质量分数大于理论值的原因可能是(填符号)
导致铜的质量分数小于理论值的原因可能是(填符号)
【答案】
(1)Mg+2HCl=MgCl2+H2↑
(2)分液漏斗
(3)![]() ,(1﹣
,(1﹣ ![]() )
)
(4)bc,a
【解析】解:(1)镁与盐酸反应生成氯化镁与氢气,反应的化学方程式为Mg+2HCl=MgCl2+H2↑,
故答案为:Mg+2HCl=MgCl2+H2↑;
(2)根据装置图可知仪器①的名称为分液漏斗,②的名称为量筒,
故答案为:分液漏斗;
(3)甲组同学利用重量法为思路,则残余的固体即为铜的质量,所以铜的质量分数为 ![]() ×100%,乙组同学利用排水法测量气体体积为思路,根据氢气的体积V结合密度计算得氢气的质量为ρV×10﹣3g,再根据Mg+2HCl=MgCl2+H2↑,可知参加反应的镁的质量为
×100%,乙组同学利用排水法测量气体体积为思路,根据氢气的体积V结合密度计算得氢气的质量为ρV×10﹣3g,再根据Mg+2HCl=MgCl2+H2↑,可知参加反应的镁的质量为 ![]() ×ρV×10﹣3g,样品中铜的质量为m1g﹣
×ρV×10﹣3g,样品中铜的质量为m1g﹣ ![]() ×ρV×10﹣3g,所以铜的质量分数为
×ρV×10﹣3g,所以铜的质量分数为 ![]() ×100%=(1﹣
×100%=(1﹣ ![]() )×100%,
)×100%,
故答案为: ![]() ; (1﹣
; (1﹣ ![]() )×100%;
)×100%;
(4)a.读取量筒中水的体积时,未等装置中气体恢复至室温,则读得的氢气的体积偏大,导致铜的质量分数小于理论值;
b.未考虑B、C装置间连接导管中残留的水,则测得的氢气的体积偏小,导致铜的质量分数大于理论值;
c.未对反应后剩余的残余物进行洗涤,使得测得的铜的质量偏大,导致铜的质量分数大于理论值;
d.用排水法测量氢气的体积,挥发出的HCl气体对实验没有影响;
故答案为:bc;a.
解:(1)铜与镁中只有镁能与盐酸反应生成氯化镁与氢气;(2)根据装置图可知仪器①的名称为分液漏斗,②的名称为量筒;(3)定量分析实验,首先要弄清实验思路及原理。甲组同学利用重量法为思路,则残余的固体即为铜的质量;乙组同学利用排水法测量气体体积为思路,根据氢气的体积V结合密度计算得氢气的质量进而求出Mg的质量再求Cu的质量。(4)温度影响氢气的体积;b.装置转接特点影响精确度,未考虑B、C装置间连接导管中残留的水,则测得的氢气的体积偏小,导致铜的质量分数大于理论值;c.未对反应后剩余的残余物进行洗涤,使得测得的铜的质量偏大,导致铜的质量分数大于理论值;d.用排水法测量氢气的体积,挥发出的HCl气体对实验没有影响。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表.下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣5mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置图的叙述中,正确的是( ) 
A.装置①可用于分离碘和氯化钠的固体混合物
B.装置②可用于吸收HCl或NH3气体
C.装置③可用于分解NH4HCO3制备NH3
D.装置④b口进气可收集CO2或NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100%
×100%
②c= ![]()
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A.①③
B.②③
C.①②
D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①其它条件不变时,缩小容器体积,平衡H2(g)+I2(g)2HI(g)不移动,体系颜色不变
②常温下, ![]() =10﹣10的溶液中:Na+、Al3+、SO42﹣、NO3﹣可大量共存
=10﹣10的溶液中:Na+、Al3+、SO42﹣、NO3﹣可大量共存
③将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
④为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸.
A.全错
B.只有④正确
C.①③④正确
D.①②③正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
A.v(O2)=0.01 molL﹣1s﹣1
B.v(NH3)=0.02molL﹣1s﹣1
C.v(H2O)=0.06 molL﹣1min﹣1
D.v(NO)=0.03molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学反应的离子方程式,其中正确的是:( )
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3﹣+2OH﹣ ![]() ?NH3↑+SO32﹣+2H2O
?NH3↑+SO32﹣+2H2O
B.向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2﹣+4NH4++2H2O
C.大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+和Na+ . 某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是( ) 
A.原溶液中c(Fe3+)=0.2molL﹣1
B.SO42﹣、NH4+、Na+一定存在,CO32﹣一定不存在
C.要确定原溶液中是否含有Fe2+ , 其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
D.溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com