
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。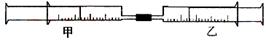
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40 mL HCl | 40 mLNH3 | 产生白烟 |
| 2 | 40 mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30 mL NO | 15 mL O2 | |
| 4 | 20 mL AlCl3溶液 | 10 mL NaOH溶液 | 生成白色沉淀,后消失 |

(1)3Cl2+4NH3¾®N2+2NH4Cl+4HCl (2分) (写成3Cl2+2NH3¾®N2+6HCl; HCl + NH3¾®NH4Cl或3Cl2+8NH3¾®N2+6NH4Cl得1分;只写3Cl2+2NH3¾®N2+6HCl不得分)
(2)2(或1:2或1体积水溶解2体积氯气。合理即可)(1分)
(3)15 mL<V<30 mL (2分)(只写小于30 mL得1分)
(4)0.8 mol/L(2分)
(5)过氧化钠或Na2O2(1分) 氧气或O2(1分)
(6)① c. (1分) ②-0.05 或-5%(2分)(没有负号不得分)
解析试题分析:(1)氯气和氨气发生氧化还原反应,氯气氧化氨气为氮气,氯气被还原为氯化氢气体,依据定量关系可知氨气过量一部分,氯化氢和氨气反应生成氯化铵是固体颗粒,冒白烟;反应的化学方程式为:3Cl2+4NH3=N2+2NH4Cl+4HCl;
(2)40mL Cl2在10mL水溶解,最后剩余气体为20mL,则依据气体体积比表示的溶解度为1:2;
(3)30mL NO与15mL O2混合发生反应2NO+O2=2NO2,所以前后反应生成二氧化氮气体体积为30ml,又二氧化氮可以聚合为四氧化二氮气体2NO2?N2O4,但反应是可逆反应不能全部转化,所以最后容器中的气体体积介于15ml~30ml;
(4)AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,氢氧化钠和氯化铝反应生成氢氧化铝沉淀,氢氧化钠过量会溶解氢氧化铝,沉淀恰好溶解反应的离子方程式为:
所以得到
Al3+ + 4OH- =Al(OH)4-
1 4
0.1mol/L×0.02L c(OH-)×0.01L
计算得到c(NaOH)=0.8mol/L;
(5)在甲、乙针筒之间连接一段硬质玻璃管,如下图.在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体.将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半.A处的物质依据颜色和与气体反应的性质可知,为Na2O2;乙中气体为二氧化碳,和过氧化钠反应后生成气体为氧气,2Na2O2+CO2=2Na2CO3+O2
(6)①测定空气中氧气的体积分数是利用空气中氧气反应,其他气体不反应;
a.碳粉和氧气反应生成二氧化碳,不能测定气体体积变化后氧气的体积,故a不符合;
b.二氧化锰不能和空气中 氧气反应,不能测定,故B不符合;
c.铜粉和氧气反应生成氧化铜,可以测定气体减小,计算氧气的条件分数,故C符合;
d.氧化铜不能和空气中氧气反应,不能测定体积分数,故d不符合;故选c.
②乙针筒内装有50mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL.体积变化为氧气=50ml-40.5ml=9.5ml,氧气体积分数=9.5ml/50ml×100%=0.19,所以相对误差=(0.2-0.19)÷0.2×100%=5%,故答案为:-5%
考点:本题考查的是氨气、氯气、氮的化合物过氧化钠等物质的性质应用,实验现象分析和定量计算是考查重点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:单选题
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
| A.②③①④ | B.③②①④ |
| C.③①②④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)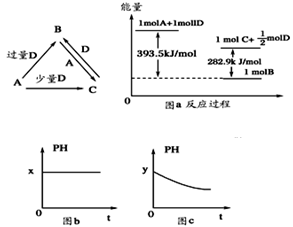
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为_________
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为___________
②反应B+A→C的离子方程式为____________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中x________7(填“﹥”“﹤”“=”)。②若图c符合事实,则其pH变化的原因是_______(用离子方程式表示)
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)____________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)________________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A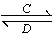 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________________________;由A转化为B的离子方程式为___________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:
________________________________________________________________________。
A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是____________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
完成下列填空
(1)向煤中加入适量的 ,可以大大减少燃烧产物中SO2的量。
(2)铝制品具有良好抗腐蚀性的原因是 。
(3)在少量的胆矾晶体中加入3 mL浓硫酸,片刻后变白色,证明浓硫酸具有 性。
(4)区别氯化铁溶液与氢氧化铁胶体的实验名称是 实验。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用下图所示装置进行实验(夹持装置已略去)。请回答下列问题: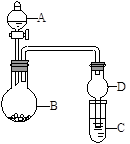
(1)若A中为浓硝酸,B中为铜单质,C中为氢氧化钠溶液。现将浓硝酸滴入B中,则B中发生反应的化学方程式为 。
(2)若A中为浓氨水,B中为生石灰,C中为明矾溶液。
①将浓氨水逐滴滴入B中,可产生大量氨气,原因可能是 _ (填序号)。
a.生石灰和浓氨水反应产生氨气,氨气易溶于水
b.生石灰和水反应,消耗水,使氨气的溶解量减少
c.反应放出大量热,使氨气在水中溶解度明显降低
② C中通入过量氨气时,反应的离子方程式为 。
(3)若A中为水,B中为过氧化钠,C中为酸性淀粉碘化钾溶液,将水滴入B中后,B中的实验现象为 ;若C中溶液变为蓝色,则C中发生反应的离子方程式为_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大。A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子。请回答下列问题:
(1)元素E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为 ;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是 。
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有 (写出所有化合物,用化学式表示,下同),呈酸性的有 (写出所有化合物)。
(4)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系: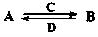 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。常温下,A、B浓度均为0.1mol·L-1的混合溶液中,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com