
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| ||
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、原子半径:W>Y>Z>M>X |
| B、化合物甲中可能含有离子键和共价键 |
| C、由W元素形成的单质在自然界的贮量丰富,并存在大量的单质 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
查看答案和解析>>
科目:高中化学 来源: 题型:
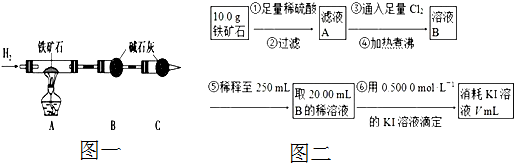
查看答案和解析>>
科目:高中化学 来源: 题型:
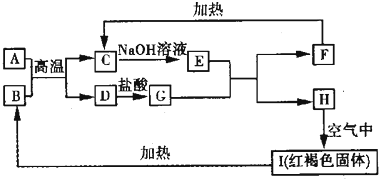
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象及解释 |
| A | 过量铁粉逐渐加入到一定量的浓硝酸中 | 溶液最终变为浅绿色是因为浓硝酸变稀后,稀硝酸只能把铁氧化成Fe2+:Fe+2H+═Fe2++H2↑ |
| B | 向水杨酸(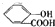 )中液加NaHCO3溶液 )中液加NaHCO3溶液 | 放出无色气体是因为水杨酸的酸性强于碳酸,反应生成CO2气体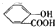 +2HCO3-═ +2HCO3-═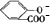 +2CO2↑+2H2O, +2CO2↑+2H2O, |
| C | 利用右边装置完成碳酸、醋酸和硅酸的酸性强弱比较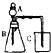 | B中固体溶解并产生气泡,C中出现白色沉淀是因为酸性:醋酸碳酸大于硅酸;B中离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 含有等浓度的SO42-和CO32-的溶液中滴加BaCl2溶液,将沉淀一分为二,一份经检验只含BaSO4,另一份放入饱和碳酸钠溶液一段时间,取出沉淀洗涤后放入盐酸中 | 放入盐酸中的沉淀溶解,且有气泡产生是因为Ksp[BaSO4]=1.1×10-30<Ksp[BaCO3]=5.1×10-9,因此SO42-先沉淀.但二者溶度积相差不大,BaSO4(s)+CO32-?BaCO3(s)+SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 试剂 | 主要操作 |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 过滤 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com