
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向浓度均为0.1mol?L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、0.045mol/L |
| B、0.035mol/L |
| C、0.055mol/L |
| D、0.040mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组探究NO3-在不同环境中的氧化性.
某研究性学习小组探究NO3-在不同环境中的氧化性.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
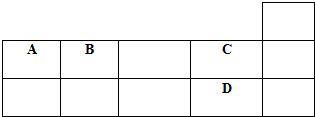
| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯硝化,苯酚和溴水反应,皂化反应,油脂的硬化 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.| V2O5 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com