
【题目】(化学——物质结构与性质)
离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的 EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
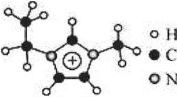
碳原子价层电子的轨道表达式为_____;基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_____形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_____。NH3比PH3的沸点高,原因是______.
(3)氮元素的第一电离能比同周期相邻元素都大的原因是_____。
(4)己知分子中的大![]() 键可用符号
键可用符号![]() 表示,其中n代表参与形成大
表示,其中n代表参与形成大![]() 键的原子数,m代表参与形成大
键的原子数,m代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() )。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+ 离子中碳原子杂化方式有:_____,其中的大
)。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+ 离子中碳原子杂化方式有:_____,其中的大![]() 键应表示为_____.
键应表示为_____.
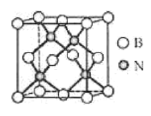
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为_____。已知:立方氮化硼密度为dg/cm3, B原子半径为xpm,N原子半径为xpm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为______(列出化简后的计算式)。
【答案】![]() 哑铃 NH3 NH3间存在氢键,分子间作用力大于PH3 基态氮原子电子占据的最高能级为半充满,较稳定 sp2、sp3
哑铃 NH3 NH3间存在氢键,分子间作用力大于PH3 基态氮原子电子占据的最高能级为半充满,较稳定 sp2、sp3 ![]() 原子 4
原子 4 ![]() ×100%
×100%
【解析】
(1)碳原子价电子数为4,价电子排布式为2s22p2,所以价层电子的轨道表达式为![]() ;基态碳原子核外电子占据的最高能级为2p,p的电子云轮廓图为哑铃形;
;基态碳原子核外电子占据的最高能级为2p,p的电子云轮廓图为哑铃形;
(2)NH3中N原子价层电子对个数=3+![]() =4,NO3-中N原子价层电子对个数=3+
=4,NO3-中N原子价层电子对个数=3+![]() ;NO2-中N原子价层电子对个数=2+
;NO2-中N原子价层电子对个数=2+![]() ,所以中心原子价层电子对数不同于其他其他两种粒子的是NH3;NH3比PH3的沸点高是因为氨分子间存在氢键;
,所以中心原子价层电子对数不同于其他其他两种粒子的是NH3;NH3比PH3的沸点高是因为氨分子间存在氢键;
(3)VA族比同周期相邻元素都大,是因为最高能级p轨道上电子数为特殊的半充满状态,能量低、较稳定;
(4)根据图1中EMIM+离子中键总数为5个,根据信息,EMIM+离子中C原子的VSEPR模型有四面体和平面三角形两种,即C原子采用sp3、sp2杂化,EMIM+离子有6个电子可形成大π键,可用符号Π56表示;
(5)立方氮化硼硬度仅次于金刚石,晶体类型类似于金刚石,是原子晶体;晶胞中每个N原子连接4个B原子,氮化硼化学式BN,所以晶胞中每个B原子也连接4个N原子,即硼原子的配位数为4;晶胞中N原子数为4,B原子数=8×![]() ,晶胞的质量m=
,晶胞的质量m=![]() ,晶胞的体积V=
,晶胞的体积V=![]() =
=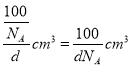 ,B、N原子总体积V’=4×[
,B、N原子总体积V’=4×[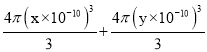 ]=
]=![]() cm3,晶胞中原子的空间利用率=
cm3,晶胞中原子的空间利用率=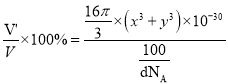 ×100%=
×100%=![]() ×100%。
×100%。
(1)碳原子价电子数为4,价电子排布式为2s22p2,所以价层电子的轨道表达式为![]() ;基态碳原子核外电子占据的最高能级为2p,p的电子云轮廓图为哑铃形;
;基态碳原子核外电子占据的最高能级为2p,p的电子云轮廓图为哑铃形;
(2)NH3中N原子价层电子对个数=3+![]() =4,NO3-
=4,NO3-![]() ;NO2-中N原子价层电子对个数=2+
;NO2-中N原子价层电子对个数=2+![]() ,所以中心原子价层电子对数不同于其他其他两种粒子的是NH3;NH3比PH3的沸点高是因为氨分子间存在氢键;
,所以中心原子价层电子对数不同于其他其他两种粒子的是NH3;NH3比PH3的沸点高是因为氨分子间存在氢键;
(3)VA族比同周期相邻元素都大,是因为最高能级p轨道上电子数为特殊的半充满状态,能量低、较稳定;
(4)根据图1中EMIM+离子中键总数为5个,根据信息,EMIM+离子中C原子的VSEPR模型有四面体和平面三角形两种,即C原子采用sp3、sp2杂化,EMIM+离子有6个电子可形成大π键,可用符号Π56表示,故答案为:sp3、sp2;Π56;
(5)立方氮化硼硬度仅次于金刚石,晶体类型类似于金刚石,是原子晶体;晶胞中每个N原子连接4个B原子,氮化硼化学式BN,所以晶胞中每个B原子也连接4个N原子,即硼原子的配位数为4;晶胞中N原子数为4,B原子数=8×![]() ,晶胞的质量m=
,晶胞的质量m=![]() ,晶胞的体积V=
,晶胞的体积V=![]() =
=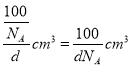 ,B、N原子总体积V’=4×[
,B、N原子总体积V’=4×[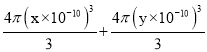 ]=
]=![]() cm3,晶胞中原子的空间利用率=
cm3,晶胞中原子的空间利用率=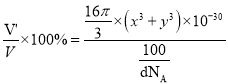 ×100%=
×100%=![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用于制取氧气。
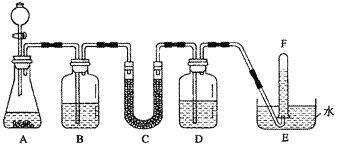
(1)A是用CaCO3制取CO2的装置。写出A中发生反应的化学方程式:
。
(2)按要求填写表中空格:
仪器编号 | 盛放的试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | |
C | 与CO2反应,产生O2 | |
D | 吸收未反应的CO2气体 |
(3)为了达到实验目的, (填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;若你认为需要增加一个吸收水蒸气装置,应选用 作为吸水剂;若你认为不需要,请说明理由是 。
(4)证明收集到的气体是氧气的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
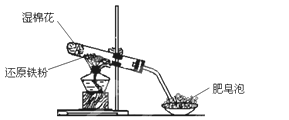
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
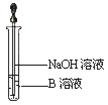
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关煤的综合利用如图所示。下列说法正确的是
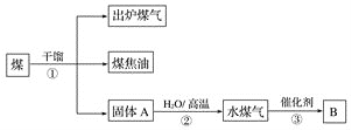
A. ①是将煤在空气中加强热使其分解的过程
B. 煤中含有苯、甲苯、二甲苯等有机物
C. ②是放热的过程
D. B为甲醇或乙酸时,原子利用率均达到100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置看,图中尚缺少的一种玻璃用品是_______________。
(2)两烧杯间填满碎纸条的作用是________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是_____________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________(填“偏大”、“偏小”或“无影响”)。
(5)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示,是原电池的装置图。
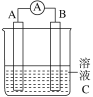
请回答:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为________________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
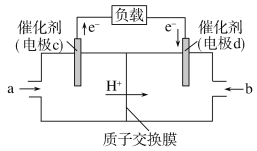
电池总反应为2CH3OH+3O2===2CO2+4H2O,
①则c电极是_______(填“正极”或“负极”),c电极的反应方程式为____________________________。
②若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
II.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
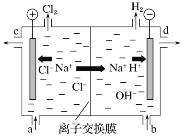
(1)写出电解饱和食盐水的离子方程式:____________________________________________。
(2)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中______位置流出(选填“a”、“b”、“c”或“d”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。实验室常用CaCO3为原料制备过氧化钙,流程如图:
![]()
下列说法不正确的是
A. 逐滴加入稀盐酸后,将溶液煮沸的作用是除去溶液中多余的CO2
B. 加入氨水和双氧水后的反应为:CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O
C. 生成CaO2的反应需要在冰浴下进行的原因是温度过高时过氧化氢分解
D. 产品依次用蒸馏水、无水乙醇洗涤,其中乙醇洗涤的目的是为了除去晶体表面的NH4Cl杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com