
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________,N、O、S元素的原子对键合电子吸引力最大的是___________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN中含有的π键的数目为__________。与CN互为等电子体的离子或分子有__________(写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________(填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为___________g/cm3。

【答案】[Ar]3d9或1s22s22p63s23p63d9 O 2NA或2×6.02×1023 C22-、CO、N2(其它答案合理均可以) NH3 极性 平面正方形 sp3 H2SO4与H2SO3分别可表示为(HO)2SO2和(HO)2SO,前者非羟基氧(2个)多于后者的非羟基氧(1个)的数目,使H2SO4中的S-O-H中的O的电子更偏向于S,越容易电离出H+,酸性更强 CuO 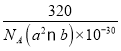
【解析】
(1)CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个形成Cu2+;元素的非金属性越强,其对键合电子吸引力就越强;
(2)共价单键只有1个σ键;共价双键含有1个σ键、1个π键;共价三键含有1个σ键、2个π键;原子总数相同、价电子总数也相同的微粒互为等电子体,CN-与N2互为等电子体,二者价键结构相同,即CN-中含有C≡N三键,三键含有1个σ键、2个π键;
(3)配位体中的中心原子提供孤对电子,根据Cu(NH3)2Cl2有两种同分异构体,结合相似性相溶原理分析物质的分子极性和空间构型;
(4)根据NH3的价层电子对数,得出杂化类型;
非金属含氧酸的酸性大小取决于非羟基氧的数目,非羟基氧原子数目越多,物质的酸性就越强;
(5)根据均摊法可以计算晶胞中含有的Cu、O原子个数,然后根据ρ=![]() 计算密度。
计算密度。
(1)CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个形成Cu2+,因此Cu2+的核外电子排布式是1s22s22p63s23p63d9,也可写为[Ar]3d9;元素的非金属性越强,其对键合电子吸引力越强,S、O、N三种元素的非金属性O>N>S,则三种原子对键合电子吸引力由大到小的顺序是O>N>S,所以对键合电子吸引力最大的是O;
(2)在CN-中存在C、N三键,其中含有1个σ键,两个π键,则1mol CN-中含有的π键的数目为2NA;
等电子体是指原子总数相同,价电子总数也相同的微粒,所以与CN-互为等电子体的离子有:C22-,分子有N2、CO;
(3)在[Cu(NH3)4]2+中,提供孤对电子的是配位体NH3分子中的N原子;Cu(NH3)2Cl2有两种同分异构体,其中一种易溶于水,根据相似相溶原理,水是极性分子,所以该分子应该为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;
(4)NH3的价层电子对数=3+![]() =4,所以N原子杂化类型为sp3杂化;
=4,所以N原子杂化类型为sp3杂化;
非金属含氧酸的酸性大小取决于非羟基氧的数目,H2SO4的非羟基氧2个,H2SO3的非羟基氧1个,使得H2SO4中的S-O-H中的O的电子更偏向于S,越容易电离出氢离子,酸性更强,所以酸性H2SO4强于H2SO3;
(5)如图所示,根据均摊法可以计算出Cu全部在体内:4个;O在顶点、面上、棱上和体心,即8×+4×
![]() +2×
+2×![]() +1=4,所以Cu和O原子个数最简整数比为1:1,因此物质的化学式为CuO;晶体密度ρ=
+1=4,所以Cu和O原子个数最简整数比为1:1,因此物质的化学式为CuO;晶体密度ρ=![]() =
=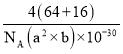 g/cm3=
g/cm3=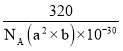 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸在二氧化硫催化氧化时采用高温来提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂来加快反应速率
C. 用饱和食盐水来除去氯气中氯化氢杂质
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1mol某烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4L,同时得到16.2g水。
(1)该烃的摩尔质量为______________。
(2)该烃的分子式为____________________。
(3)该烃有一种可能的结构为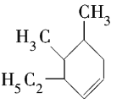 ,其系统命名为___________。
,其系统命名为___________。
(4) 属于______________(选填序号)。
属于______________(选填序号)。
a.环烃b.烷烃c.芳香烃d.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油的成分之一,它的结构简式是![]() ,下列叙述中不正确的是 ( )
,下列叙述中不正确的是 ( )
A.1 mol胡椒酚最多可与4 mol H2发生反应
B.1 mol胡椒酚最多可与4 mol Br2发生反应
C.胡椒酚可与NaOH溶液反应
D.胡椒酚在水中的溶解度不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(分子式C8H8O3)为无色液体,难溶于水,有特殊香味。从A出发,可发生如下图所示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能发生银镜反应。

回答下列问题:
(1)写出下列化合物可能的结构简式:
A________,E_______,K ________。
(2)反应类型(Ⅰ)________,(Ⅱ)________,(Ⅲ)_______。
(3)反应方程式:H―→K_________,C+F―→_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 聚乙烯不能使酸性KMnO4溶液褪色
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是
A.已知中和热为57.3 kJ/mol:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ/mol
B.1 mol SO2与2 mol O2在某密闭容器中反应放出88 kJ热量,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=-176 kJ/mol
2SO3(g) △H=-176 kJ/mol
C.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D.8 g 固体硫完全燃烧生成SO2,放出74kJ热量:S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com