
【题目】[化学——选修3:物质结构与性质](15分)
人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式__________。
(2)1个Cu2+与2个H2N—CH2—COO形成含两个五元环结构的内配盐(化合物),其结构简式为_______________(用→标出配位键),在H2N—CH2—COO中,属于第二周期的元素的第一电离能由大到小的顺序是__________(用元素符号表示),N、C原子存在的相同杂化方式是_________杂化。
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是_____________,解释出现此规律的原因是____________________________________。
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:
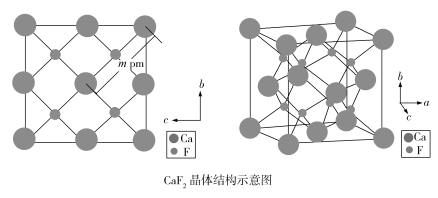
①两个最近的F之间的距离是___________pm(用含m的代数式表示)。
②CaF2晶胞体积与8个F形成的立方体的体积比为___________。
③CaF2晶胞的密度是___________g·cm3(化简至带根号的最简式,NA表示阿伏加德罗常数的值)。
[化学——选修5:有机化学基础](15分)
药物H在人体内具有抑制白色念球菌的作用,H可经下图所示合成路线进行制备。
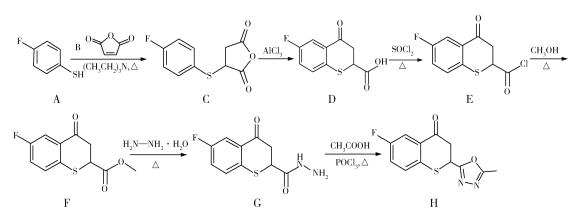
已知:硫醚键易被浓硫酸氧化。
回答下列问题:
(1)官能团SH的名称为巯(qiú)基,SH直接连在苯环上形成的物质属于硫酚,则A的名称为________________。D分子中含氧官能团的名称为________________。
(2)写出下列反应类型:A→C_____________,E→F_____________。
(3)F生成G的化学方程式为_______________________________________。
(4)下列关于D的说法正确的是_____________(填标号)。(已知:同时连接四个各不相同的原子或原子团的碳原子称为手性碳原子)
A.分子式为C10H7O3FS
B.分子中有2个手性碳原子
C.能与NaHCO3溶液、AgNO3溶液发生反应
D.能发生取代、氧化、加成、还原等反应
(5)M与A互为同系物,分子组成比A多1个CH2,M分子的可能结构有_______种;其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的物质的结构简式为_____________。
(6)有机化合物K(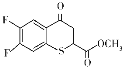 )是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以
)是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以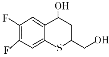 为原料的合成K的路线。_____________
为原料的合成K的路线。_____________
【答案】[Ar]3d6(或1s22s22p63s23p63d6) 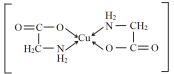 N>O>C sp3 随着这类金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高 金属离子半径越小,其与碳酸根离子中氧的作用力越强,与碳的作用力则减弱,对应的碳酸盐就越容易分解(或其他合理答案)
N>O>C sp3 随着这类金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高 金属离子半径越小,其与碳酸根离子中氧的作用力越强,与碳的作用力则减弱,对应的碳酸盐就越容易分解(或其他合理答案) ![]() 8∶1
8∶1  4氟硫酚(或对氟硫酚) 羧基,羰基 加成反应 取代反应
4氟硫酚(或对氟硫酚) 羧基,羰基 加成反应 取代反应  AD 13
AD 13 ![]()

【解析】
[化学——选修3:物质结构与性质]
(1)Fe的核电荷数为26,核外电子排布式[Ar]3d64s2或1s22s22p63s23p63d64s2,Fe2+的核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6。
(2)1个Cu2+与2个H2N—CH2—COO形成的盐,因为含两个五元环结构,所以结构为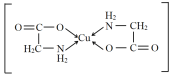 ;在H2N—CH2—COO中,属于第二周期元素的是C、N、O,第一电离能由大到小的顺序是N>O>C,在H2N—CH2—COO中,N的杂化方式为sp3、C的杂化方式为sp3和sp2,相同的是sp3杂化。
;在H2N—CH2—COO中,属于第二周期元素的是C、N、O,第一电离能由大到小的顺序是N>O>C,在H2N—CH2—COO中,N的杂化方式为sp3、C的杂化方式为sp3和sp2,相同的是sp3杂化。
(3)随着金属离子半径的增大,碳酸盐的热分解温度逐步升高;一般认为,含氧酸盐热分解的本质是金属离子争夺含氧酸根中的氧元素,金属离子的半径越小,夺取含氧酸根中的氧的能力越强,含氧酸盐的热分解温度越低,越易分解。
(4)①根据侧面图可看出,2m pm为面对角线的长度,边长为![]() pm,两个最近的F之间的距离为立方体边长的一半,所以两个最近的F之间的距离为
pm,两个最近的F之间的距离为立方体边长的一半,所以两个最近的F之间的距离为![]() pm。
pm。
②观察晶胞,可看出8个F形成的小立方体的边长为CaF2晶胞边长的![]() ,所以CaF2晶胞体积与8个F形成的立方体的体积比为(2∶1)3=8∶1。
,所以CaF2晶胞体积与8个F形成的立方体的体积比为(2∶1)3=8∶1。
③根据图示可知CaF2晶胞中含4个Ca2+和8个F,它的边长为![]() pm=
pm=![]() ×1010 cm,利用ρVNA =4M得出ρ=
×1010 cm,利用ρVNA =4M得出ρ=![]() g·cm3=
g·cm3= g·cm3。[化学——选修5:有机化学基础](15分)
g·cm3。[化学——选修5:有机化学基础](15分)
(1)F原子在硫酚的官能团巯基对位上,习惯命名法的名称为对氟硫酚,科学命名法的名称为4氟硫酚;D分子中含氧官能团有羧基,羰基两种。
(2)A→C为巯基与B分子碳碳双键的加成反应,E→F为E与甲醇的取代反应。
(3)F→G的过程中,F中的OCH3被NHNH2代替,生成G的同时生成CH3OH和H2O,反应的方程式为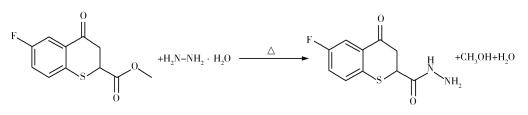 。
。
(4)由结构简式可推出其分子式为C10H7O3FS,A正确;分子中只有一个手性碳原子,B错误;分子中的羧基能够与NaHCO3溶液反应,但F原子不能直接与AgNO3溶液发生反应,C错误;能发生取代(如酯化)、氧化、加成(羰基、苯环)、还原(羰基)等反应,D正确。
(5)根据描述,其分子式为C7H7FS,有SH直接连在苯环上,当苯环上连有SH和CH2F两个取代基时,共有3种同分异构体,当苯环上连有SH、CH3和F三个取代基时,共有10种同分异构体,合计共13种同分异构体,其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的物质的结构简式为![]() 。
。
(6)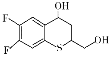 到
到 ,首先应该把
,首先应该把 分子中的仲醇部分氧化为羰基,把伯醇(CH2OH)部分氧化为羧基,然后模仿本流程中的D→E→F两个过程,得到K。
分子中的仲醇部分氧化为羰基,把伯醇(CH2OH)部分氧化为羧基,然后模仿本流程中的D→E→F两个过程,得到K。


科目:高中化学 来源: 题型:
【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确的是( )
A.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.CH2=CH2+HCl→CH2CH3Cl
C.CH3COOH+CH3CH2OH![]() CH3COCH3CH2O+H2O
CH3COCH3CH2O+H2O
D.![]() +Br2
+Br2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验创新小组设计了如图所示的检验Cl2某些性质的一体化装置。下列有关描述不正确的是
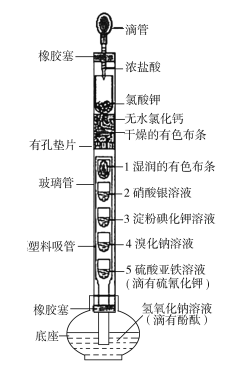
A.浓盐酸滴到氯酸钾固体上反应的离子方程式为5Cl+![]() +6H+===3Cl2↑+3H2O
+6H+===3Cl2↑+3H2O
B.无水氯化钙的作用是干燥Cl2,且干燥有色布条不褪色,湿润的有色布条褪色
C.2处溶液出现白色沉淀,3处溶液变蓝,4处溶液变为橙色,三处现象均能说明了Cl2具有氧化性
D.5处溶液变为血红色,底座中溶液红色消失,氢氧化钠溶液的作用为吸收剩余的Cl2以防止污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如下:
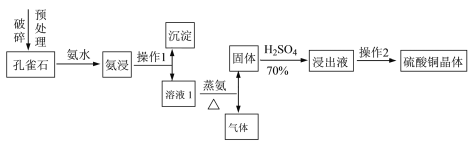
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是____________________。
(2)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O![]() [Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
(3)蒸氨出来的气体有污染,需要净化处理,下图装置中合适的为___________(填标号);经吸收净化所得的溶液用途是_______________(任写一条)。
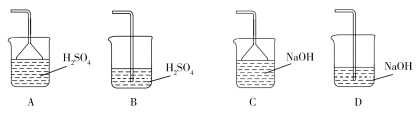
(4)操作2为一系列的操作,通过加热浓缩、冷却结晶、___________、洗涤、___________等操作得到硫酸铜晶体。
Ⅱ.采用金属铜单质制备硫酸铜晶体
(5)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是______________________(任写两条)。
(6)某兴趣小组查阅资料得知:Cu+CuCl2![]() 2CuCl,4CuCl+O2+2H2O
2CuCl,4CuCl+O2+2H2O![]() 2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4
2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4![]() CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
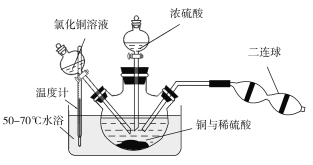
向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。
①盛装浓硫酸的仪器名称为___________。
②装置中加入CuCl2的作用是______________;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为______________________。
③若开始时加入a g铜粉,含b g氯化铜溶质的氯化铜溶液,最后制得c g CuSO4·5H2O,假设整个过程中杂质不参与反应且不结晶,每步反应都进行得比较完全,则原铜粉的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mL SO2溶于水制成100 mL溶液,H2SO3、![]() 、
、![]() 三者数目之和为0.01NA
三者数目之和为0.01NA
D.含63 g HNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。正极电极反应式为__,随着反应的进行,正极附近溶液的酸性将__。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为__,当线路中转移0.4mol电子时,则被腐蚀铜的质量为__g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为__。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
(4)如图是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,A极为电源(填“正”或“负”)___极,写出A极的电极反应式:___。
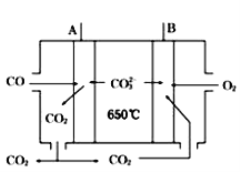
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同主族元素形成的同类型的化合物,往往其结构和性质相似。下列对化合物碘化磷(PH4I)的叙述错误的是( )
A.它是一种离子化合物
B.这种化合物加热时,可能产生有色气体
C.这种化合物的电子式为: 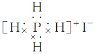
D.这种化合物可以和烧碱发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
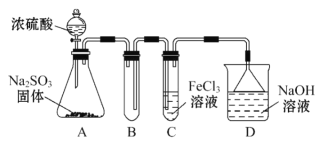
(1)通入足量SO2时C中观察到的现象为____。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___;
②C装置中所盛装的FeCl3溶液为5mL,物质的量浓度为2.0mol·L-1,欲使其完全被SO2还原,则至少需要Na2SO3固体___g;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO![]() 。该做法___(填“合理”或“不合理”),理由是___。
。该做法___(填“合理”或“不合理”),理由是___。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有___(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com