
【题目】25℃下,根据三种酸的电离常数,下列判断正确的是
酸 | HX | HY | HZ |
电离常数K | 1×10-7 | 9×10-6 | 1×10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液碱性最强
C.反应HX+Y-=HY+X-能够发生
D.25℃时,0.1 mol/L HX溶液的pH约为4
【答案】D
【解析】
A.酸的电离平衡常数越大,酸的电离程度越大,其溶液的酸性越强,根据表中数据知,酸的电离平衡常数HZ>HY>HX,则酸性强弱关系:HZ>HY>HX,A错误;
B.根据盐的水解规律:有弱才水解,谁弱水水解,谁强显谁性,越弱越水解,由于酸性HZ>HY>HX,,所以相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaX溶液水解程度增大,其水溶液的碱性最强,B错误;
C.强酸能和弱酸盐反应生成弱酸和强酸盐,由于酸性HY>HX,根据强酸制取弱酸知,反应HX+Y-=HY+X-不能够发生,C错误;
D.根据表格数据可知:在25℃时,HX的电离平衡常数K=1×10-7,假设0.1 mol/L HX溶液中HX电离产生的H+的浓度为a,根据电离平衡常数的含义可知K=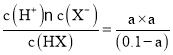 =1×10-7,a2≈1×10-8,所以a≈1×10-4,因此该溶液的pH约为4,D正确;
=1×10-7,a2≈1×10-8,所以a≈1×10-4,因此该溶液的pH约为4,D正确;
故合理选项是D。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示的装置,判断下列说法正确的是( )
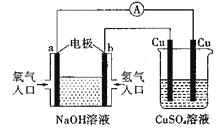
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8g时,a极上消耗O2在标准状况下的体积为4.48L
C.该装置中b极的电极反应式是:H2-2e-=2H+
D.一段时间后,左边装置中溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是

A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
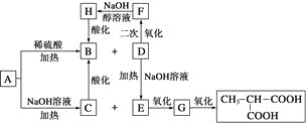
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有机化合物的命名原则,下列命名正确的是( )
A.![]() 3甲基1,3丁二烯
3甲基1,3丁二烯
B.![]() 2羟基丁烷
2羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2乙基戊烷
D.CH3CH(NH2)CH2COOH 3氨基丁酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是________,此法的最大缺点是__________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是_________________;向混合溶液中通入热空气的反应的离子方程式是___________________;由滤液得到无水硫酸铜的实验操作是______________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是_______________________。
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组模拟合成氨过程,通过仪器测得正反应速率与时间的图象如下图所示,请回答相关问题:
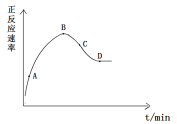
(1)合成氨过程需加入催化剂,催化剂是通过_________来增大反应速率的。
(2)正反应速率呈现出先增大后减小的原因可能是___________。
(3)v正-t图象中A、B、C、D四点属于平衡状态的是___点,你的理由是___。
(4)请在图中画出相应的逆反应速率图象_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
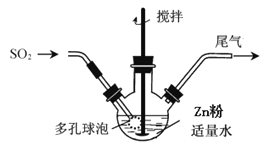
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______;容器中多孔球泡的作用是______。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体”的原理是(用必要的化学用语和文字说明)______。
(3)两种方法中控制温度的加热方式是______。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______。
(5)甲酸钠法中生成Na2S2O4的总反应为______。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
B.化学反应A2(g)+2B2(g)===2AB2(g)能量变化如图所示,该反应为放热反应
C.在25℃、101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l)△H= -285.8kJ·mol-1
2H2O(l)△H= -285.8kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)![]() H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com