
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
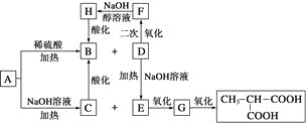
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
【答案】C8H13O2Cl 羟基、氯原子 3 ![]() CH3CH(CH2OH)2+O2
CH3CH(CH2OH)2+O2![]() CH3CH(CHO)2+2H2O ClCH2CH(CH3)COOH+2NaOH
CH3CH(CHO)2+2H2O ClCH2CH(CH3)COOH+2NaOH![]() CH2=C(CH3)COONa+NaCl+2H2O 5
CH2=C(CH3)COONa+NaCl+2H2O 5
【解析】
在相同条件下,A蒸气的质量是同体积氢气质量的88.25倍,则Mr(A)=88.25×2=176.5,故N(C)=![]() ,N(H)=
,N(H)= ![]() ≈13,N(O)=
≈13,N(O)=![]() =2,N(Cl)=
=2,N(Cl)=![]() ≈1,则A的分子式为C8H13O2Cl。根据框图,E到G,G到CH3CH(COOH)2及相关反应,如D二次氧化生成F可推知,G为CH3CH(CHO)2,E为CH3CH(CH2OH)2,则D为CH3CH(CH2Cl)CH2OH,再根据D→F→H→B可知,F为CH3CH(CH2Cl)COOH,H为CH2=C(CH3)COONa,B为CH2=C(CH3)COOH,故A的结构简式为CH2=C(CH3)COOCH2CH(CH3)CH2Cl,符合A的分子式C8H13O2Cl。
≈1,则A的分子式为C8H13O2Cl。根据框图,E到G,G到CH3CH(COOH)2及相关反应,如D二次氧化生成F可推知,G为CH3CH(CHO)2,E为CH3CH(CH2OH)2,则D为CH3CH(CH2Cl)CH2OH,再根据D→F→H→B可知,F为CH3CH(CH2Cl)COOH,H为CH2=C(CH3)COONa,B为CH2=C(CH3)COOH,故A的结构简式为CH2=C(CH3)COOCH2CH(CH3)CH2Cl,符合A的分子式C8H13O2Cl。
(1)由上述分析可知,A的分子式为C8H13O2Cl;
(2)由上述分析可知,D为CH3CH(CH2Cl)CH2OH,分子含有官能团为羟基、氯原子,故答案为:羟基、氯原子;
(3)A→B、A→C、D→E的转化属于水解反应,属于水解反应的有3个,故答案为:3;
(4)①A的结构简式为CH2=C(CH3)COOCH2CH(CH3)CH2Cl,与稀硫酸共热发生水解,方程式为:![]() ;
;
②E为CH3CH(CH2OH)2,催化氧化生成G,方程式为:CH3CH(CH2OH)2+O2![]() CH3CH(CHO)2+2H2O;
CH3CH(CHO)2+2H2O;
③F为ClCH2CH(CH3)COOH,与氢氧化钠醇溶液共热发生消去反应,方程式为:ClCH2CH(CH3)COOH+2NaOH![]() CH2=C(CH3)COONa+NaCl+2H2O;
CH2=C(CH3)COONa+NaCl+2H2O;
(5) B的分子式为C4H6O2,其碳链有两种形式:C-C-C-C,C-C(C)-C,含碳碳双键的结构有:C-C-C=C,C-C=C-C,C=C(C)2,所以属于酯的化合物有:HCOOCH2CH=CH2,CH3OOC-CH=CH2,CH3COOCH=CH2,HCOOCH=CH-CH3,CH2=(CH3)-OOCH,共5种。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。

(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以磷精矿[主要成分是Ca3(PO4)2,还含有少量Fe2O3、CaF2等杂质]为原料,生产磷酸二氢钾的流程如图:

已知:①TBP、D2EHPA、TOA都是难溶于水的液态有机物,对萃取特定物质有较强的选择性,常用作萃取剂。
②萃取剂TBP对H3PO4和Fe3+有较强的萃取作用,但对Ca2+有一定的萃取作用。
③萃取剂D2EHPA仅对Fe3+有较强的萃取作用。
回答下列问题:
(1)“制酸”过程中生成磷酸的化学方程式为______。
(2)“除氟”时发生反应的化学方程式为______。
(3)“目的1”是______。
(4)“目的2”分离出的有机层中除H3PO4外,还有少量某金属阳离子。去除有机层中该阳离子的方法是用含H2SO4的磷酸洗涤,反应的离子方程式为______。
(5)“反应”时先在磷酸中加入KCl,再加入TOA,TOA的作用是______。
(6)“反应”中,TOA的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ(含磷元素微粒占全部含磷粒子的物质的量分数)随pH的变化如图所示。

“反应”中,当pH=______(填选“2.2”、“4.5”、“9.5”或“12.4”)时,停止加入TOA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,根据三种酸的电离常数,下列判断正确的是
酸 | HX | HY | HZ |
电离常数K | 1×10-7 | 9×10-6 | 1×10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液碱性最强
C.反应HX+Y-=HY+X-能够发生
D.25℃时,0.1 mol/L HX溶液的pH约为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4mo1A和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应前与反应后的气体压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应前与反应后的气体压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是20%
C. 增加C的量,B的平衡转化率不变
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据下图中的能量关系,可求得C-H的键能为______________。

(2)X(s)+3Y(g)![]() Z(g)+3W(g) ΔH=-akJ/mol,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s后达到平衡,测得生成0.5molZ。
Z(g)+3W(g) ΔH=-akJ/mol,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s后达到平衡,测得生成0.5molZ。
①则10s内,Y的平均反应速率为_____________,第10s时,X的物质的量为__________,Y的浓度为_______,10s内,X和Y反应放出的热量Q为______。
②判断该反应是否达到平衡的依据是__________(填字母)。
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(Y)不随时间改变 D.单位时间里生成Z和W的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com