
【题目】如图是含某元素的A→G的七种物质分别与X、Y、Z反应的价类二维图。其中X是一种强碱;G为正盐;通常条件下,Z是无色液体;D的相对分子质量比C小16,各物质转化关系如图所示。下列说法正确的是![]()
![]()

A.该元素在周期表中位于第二周期第V族
B.上述转化中发生5个氧化还原反应
C.稳定性:气态F<气态Z
D.A、B、X、G四种物质分别含有离子键和共价键
【答案】C
【解析】
G为正盐,X是一种强碱,二者反应生成氢化物F,则G为铵盐、F为NH3,F连续与Y反应依次得到氧化物D、氧化物C,D的相对原子质量比 C小16,则Y为O2、D为NO、C为NO2,单质E能与氧气反应生成NO,则E为N2,通常条件下Z是无色液体,C与Z反应得到含氧酸B,则Z为H2O、B为HNO3,B与X发生酸碱中和反应得到A为硝酸盐。
由题意可知及转化关系可知:A为硝酸盐,B为HNO3,C为NO2,D为NO,E为N2,F为NH3,X是一种强碱;Y为O2,Z为H2O,G为正盐。
A. 根据上述分析可知:该元素为N元素,N元素在周期表中位于第二周期第VA族,A错误;
B. 上述转化中发生的F→D,E→D,D→C,C→B四个反应都属于氧化还原反应,故C错误;
C. F为NH3,Z为H2O,元素的非金属性越强,其简单氢化物的稳定性就越强。由于元素的非金属性O>N,所以氢化物的稳定性:NH3<H2O,C正确;
D. B为HNO3,有分子构成,B分子中只含有共价键,D错误;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):![]() 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
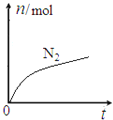
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变成0.5mol/L,在这5s 内B的化学反应速率为多少______?
(2)一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余 6.8mol,这种反应物的化学反应速率为多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
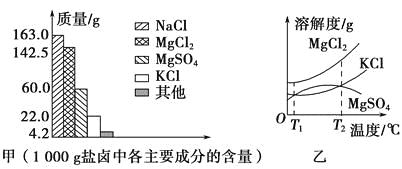
【题目】我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要的产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如下图甲)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的试题。
(1)根据图甲,写出盐卤中含量最多的两种盐的化学式:_______、_______。
(2)下图乙是盐卤中某些物质的溶解度曲线,已知T1℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为_______;将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是______________________________________________________。
(3)化工厂利用卤水生产金属镁的工艺流程如下:
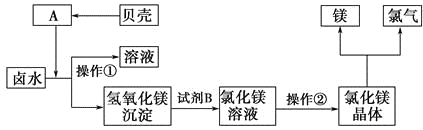
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是_______。氢氧化镁与试剂B反应的化学方程式为______________________________。
操作②的名称是_______。该方法的优点为___________________________。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中同学_______(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出CO2的空间构型:___________。
(2) 写出Na3N的电子式:____________________。
(3) 写出C2H6O的化学名称:______________________。
(4) 写出乙烯的实验式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨技术反应原理为:N2 (g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
(1)T ℃ 时,反应达到平衡,测得 υ(NH3)=0.12 mol·L-1·min -1
① υ(N2)=____mol·L-1·min -1
② 化学平衡常数表达式 K=_____
(2)在其他条件相同时,图为分别测定不同压强、不同温度下,N2 的平衡转化率。

L 表示______,其中 X1______ X2(填“>”或“<)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com