



 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
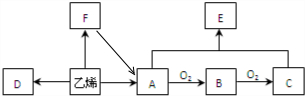
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3、Na2CO3分别与盐酸反应 |
| B、CuO分别与稀硫酸、稀盐酸、稀硝酸反应 |
| C、H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 |
| D、Na分别与水、稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯的结构简式:C3H6 |
B、3-甲基-1-丁烯的结构简式: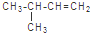 |
C、HOCH2COOH缩聚物的结构简式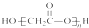 |
D、苯甲醛: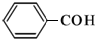 |
查看答案和解析>>
科目:高中化学 来源: 题型:
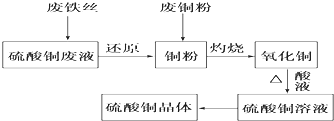
查看答案和解析>>
科目:高中化学 来源: 题型:
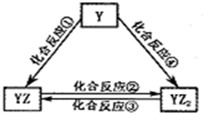 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:
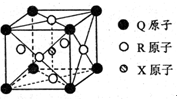 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com