
����Ŀ����������(NaN3)��������ȫ��������������巢����ԭ�ϡ������ǹ�ҵˮ���·��Ʊ��������ƵĹ������̣�
��֪ NaN3 ���� AgNO3 ��Ӧ���ɰ�ɫ������ˮ�� AgN3���й����ʵ��������������
���� | �۵�� | �е�� | �ܽ��� |
CH3OH | -97 | 64.7 | ��ˮ���� |
ˮ����(N2H4H2O) | 2 | 113.5 | ��ˮ�������ܣ����������Ѻ��ȷ� |
���������(CH3ONO) | -17 | -12 | �����Ҵ������� |
��������(NaN3) | 410(�ֽ�) | ���� | ������ˮ�������ڴ������������� |
��ش�
(1)�������NaNO2��ϡ���ᷢ������Ӧ����������������ӷ���ʽΪ��________�������������NaN3�Ļ�ѧ����ʽΪ��____________��
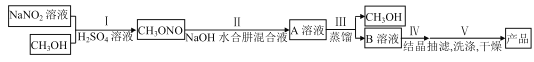
(2)ʵ����ģ�ⲽ��II ʵ��װ����ͼ(װ������ȴˮʡ�ԣ���ͬ)��
�ٸ���ʵ�鷢���¶���20�����ҷ�Ӧ��ѡ���Ժ�ת������ߣ����Ǹ÷�Ӧ���ڷ��ȷ�Ӧ����˿��Բ�ȡ�Ĵ�ʩ��_______________________��
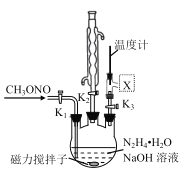
��ͼ��X�����ӵ������װ��ӦΪ��ͼ�е�______ ��
(3)���������Һ B ������������Һ�����![]() ��NaN3 �ᾧ������
��NaN3 �ᾧ������
�ٲ��������______________ϴ�Ӿ��塣
A.ˮ B.�Ҵ� C.�Ҵ�ˮ��Һ D.����
�ڳ����ζ����ⶨ��Ʒ���ȣ����Ե���ɫK2CrO4��Һ��ָʾ������AgNO3����Һ������Ʒ��Һ��������Ag2CrO4���֣�����Һ�ʵ���ɫΪ�յ㡣AgNO3��ҺҪװ����ɫ����ʽ�ζ�������еζ���������_________________________��
�����в������жϺ�������__________��
A���ζ��ܺ���Һ�ܹܼⲻ�ɽӴ���ƿ�ڱ�
B
C���ζ������п�������ˮ����ƿ����ճ������Һ����
D���ζ��յ�ʱ����δ�ȵζ���Һ���ȶ��Ͷ����ᵼ�²ⶨ���ƫ��
���𰸡�2NO2-+2H+=NO��+NO2��+H2O N2H4+CH3ONO+NaOH=NaN3+CH3OH+2H2O ��ˮԡ����ͨ������� C B AgNO3��Һ��Һ�����ԣ���AgNO3 ����ֽ⣬Ũ���½���ʹ�ⶨ�� BCD
��������
���Ʊ����̿�֪��NaNO2��Һ�ͼ״���ϡ������Һ�з�����Ӧ������CH3ONO����������Ʊ��������ƵIJ�����������ƿ�н��У��Ʊ��������ƵIJ����Ǵ�K1��K2���ر�K3��������ӦClO-+CO(NH2)2+2OH-=Cl-+N2H4H2O+CO32-������������ˮ���»����Һ�õ�A��ҺΪNaN3��CH3OH�Ļ����Һ����Ӧ����ʽΪCH3ONO+N2H4+NaOH=NaN3+CH3OH+2H2O��ͨ������õ��״���B��Һ�����������ҺB����������NaN3�ᾧ���������ˡ��Ҵ�ϴ�Ӹ���õ���Ʒ���Դ������
(1)������� NaNO2��ϡ���ᷢ������Ӧ����������������ӷ���ʽΪ2NO2-+2H+=NO��+NO2��+H2O������������� NaN3�Ļ�ѧ����ʽΪCH3ONO+N2H4+NaOH=NaN3+CH3OH+2H2O��
(2)�ٷ�Ӧ��20�����ҷ�Ӧ��ѡ���Ժ�ת������ߣ���Ӧ�����¶�20�����ң�����20��(��)ˮԡ(����ͨ��CH3ONO���壩��
��X�����ӵ������װ��Ӧ������װ�ã�����Ч����ֱ�������ܺã�����Ҫ���ӵ��ܣ��ʺ���ѡ����C��
(3)�ٲ������ϴ�Ӿ����������ʣ�ϴ�ӹ����з�ֹNaN3�ܽ⣬ˮ������ˮ�������ܣ����������Ѻ��ȷ£���������������Ҵ������ѣ�ѡ���Ҵ���ϴ�Ӿ����������ʣ��ʺ���ѡ����B��
������AgNO3ˮ��ʹ��Һ�����ԣ��Ҽ����ֽ⣬����Ũ���½���ʹ�ⶨ����AgNO3��ҺҪװ����ɫ����ʽ�ζ�������еζ���
��A���ζ��ӽ��յ�ʱ���ζ��ܵļ���ɽӴ���ƿ�ڱڣ���ʹ�ζ���������Һ���ַ�Ӧ���ζ��ܹܼ�ɽӴ���ƿ�ڱڣ�A����
B���յ�ʱ���������ܼ���������ζ�ʱӦ�ȿ���������ӽ��յ�ʱ��Ӧһ��һҡ����ֹ�Լ�������B��ȷ��
C���ζ�����������������ˮ����ƿ�ڱ�ճ������Һ���£��Դ���Һ���ʵ���û��Ӱ�죬�ζ������Ӱ�죬C��ȷ��
D����δ�ȵζ���Һ���ȶ��Ͷ������ڱ���Һδ��������ȡ�ı���Һ������ܻ����ᵼ�²ⶨ���ƫ�ߣ�D��ȷ��
�ʺ���ѡ����BCD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4�к���Fe2+��Fe3+���ֱ��ʾΪ Fe(��)��Fe(��)����Fe3O4/PdΪ�����ϣ���ʵ���� H2�������Է�ˮ�е��°��� NO2-���䷴Ӧ����ʾ��ͼ��ͼ��ʾ������˵������ȷ����
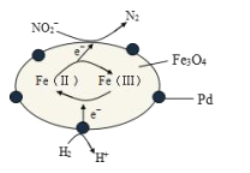
A.�ø÷�������ˮ��� pH����
B.Fe(��)�� Fe(��)���ת�����˴��ݵ��ӵ�����
C.��Ӧ������NO2-�� Fe(��)��ԭΪ N2
D.Pd �Ϸ����ĵ缫��ӦΪ��H2- 2e��== 2H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⡣
��1��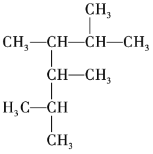 ������Ϊ______��
������Ϊ______��
��2�� ������Ϊ______��
������Ϊ______��
��3��3-��-2-��ϩ�Ľṹ��ʽΪ______��
��4��1,3,5-�������Ľṹ��ʽΪ______��
��5��ij��������Է�������Ϊ72����һ�ȴ���ֻ��һ�֣��������Ľṹ��ʽΪ______��
��6��2,3-����-2-��ϩ�ļ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ������ʵĽ����У�����ȷ����
A. ˮ���ȶ�(1000�����ϲŻᲿ�ַֽ�)����Ϊˮ�к��д��������
B. ������һ�Զ�ӳ�칹�壬��Ϊ������к���һ������̼ԭ��
C. �����������Ȼ�̼������������ˮ�����á��������ܡ�����
D. ����ͼ��֪���ԣ�H3PO4>HClO����ΪH3PO4�ķ��ǻ���ԭ�������ڴ�����ķ��ǻ���ԭ���� 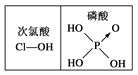
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������нϹ㷺�Ŀ������ã���ṹ��ʽ����ͼ��ʾ��

���ڿ������������������ȷ����(����)
A������ʽΪC16H13O9
B��1 mol����������뺬8 mol NaOH����Һ��Ӧ
C����ʹ����KMnO4��Һ��ɫ��˵�����ӽṹ�к���̼̼˫��
D����Ũ��ˮ�ܷ����������͵ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��dz��ɫ��X��������Ԫ�أ������ᾧˮ��M(X)<908gmol-1��ijС��Ϊ��̽��X����ɺ����ʣ���Ʋ����������ʵ��

����ʵ���У��õ�23.3g��ɫ���� E��28.8g��ɫ����G��12.8g��ɫ����H��
��֪����X�ֽ��A��B��C�ķ�ӦΪ��������ԭ��Ӧ��
�ڳ�����B��Һ̬��1��B���Ӻ���10�����ӡ�
��ش��������⣺
(1)д��B���ӵĵ���ʽ_______________��X�Ļ�ѧʽ��__________��
(2)�ڸ���������570���¶��¼���X����ȫ�ֽ�Ļ�ѧ��Ӧ����ʽΪ��__________��
(3)��д��G����D��Һ�����ӷ���ʽ��_________________��
(4)�����ʵ��������C���Ƿ��Ժ���X��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Pt-g-C3N4����������ѳ�NO�Ĺ�����ͼ��ʾ�����ѳ������У�����˵������ȷ����

A.���ѳ�������̫����ת��Ϊ��ѧ�ܡ�
B.��Pt�˷�������������Ӧ
C.���̢ٷ����ķ�ӦΪH2O2 - 2e-=O2��+ 2H+
D.���̢۵Ļ�ѧ����ʽ2NO2 + H2O2= 2HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�С�������ͼ��ʾʵ�飬�Լ�AΪ0.2mol/LCuSO4��Һ�������������������Ա仯�����Ǹı�ʵ��������̽������CuSO4��Һ��CuCl2��Һ��Ӧ��Ӱ�����ء��ò�ͬ���Լ�A����ʵ��1~ʵ��4������¼ʵ������:
ʵ����� | �Լ�A | ʵ������ |
1 | 0.2mol/LCuCl2��Һ | �������������ݲ��������к�ɫ�������� |
2 | 0.2mol/LCuSO4��Һ���ټ���һ��������NaCl���� | ��ʼ�������������Ա仯����NaCl���������������ݲ��������к�ɫ�������� |
3 | 2mol/LCuSO4��Һ | �����������������ݲ���������������ɫ���� |
4 | 2mol/LCuCl2��Һ | ��Ӧ�dz����ң��д������ݲ�������Һ����غ�ɫ���к�ɫ����Ͱ�ɫ�������� |
(1)ʵ��1�У���������������ɫ����ķ�Ӧ�����ӷ���ʽΪ_________��
(2)ʵ��2��Ŀ����֤��ͭ���е�������Cl-�ǵ���ʵ��1�з�ӦѸ�ٷ�����ԭ��ʵ��2�м���NaCl���������Ϊ______g��
(3)ʵ��3��Ŀ����_________ ��
(4)�������֪��ʵ��4�а�ɫ����ΪCuCl����ͬѧ��Ϊ������ɫ�����ԭ������Ƿ�����Cu+CuCl2=2CuCl�ķ�Ӧ�����������ͼ��ʾʵ��֤���÷�Ӧ�ܹ�������
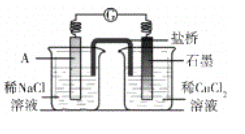
��A���ĵ缫������_________��
����֤���÷�Ӧ������ʵ��������_________ ��
(5)Ϊ̽��ʵ��4����Һ�����غ�ɫ��ԭ�ֱ�ȡ��ɫCuCl�����������ʵ��:
ʵ����� | ʵ����� | ʵ������ |
i | ����ŨNaCl��Һ | �����ܽ⣬�γ���ɫ��Һ |
ii | ���뱥��AlCl3��Һ | �����ܽ⣬�γɺ�ɫ��Һ |
iii | ��i������Һ�м���2mol/LCuCl2��Һ | ��Һ����ɫ��Ϊ��ɫ |
��������֪:CuCl������ˮ�����ܽ���Cl-Ũ�Ƚϴ����Һ�У�����[CuCl2]
��������ʵ�鼰���Ͽ��ƶϣ�ʵ��4����Һ���غ�ɫ��ԭ�������[CuCl2]-��_____���õĽ����
��Ϊȷ֤ʵ��4���õ��غ�ɫ��Һ�к���[CuCl2]-��Ӧ�����ʵ����_______��
(6)����ʵ��˵��������CuSO4��Һ��CuCl2��Һ�ķ�Ӧ������______�йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2SO2��g����O2��g��![]() 2SO3��g�������Ṥҵ������Ҫ��Ӧ����÷�Ӧ��ʹ�ô�����������Ϊ�Ӵ��������ᡣ
2SO3��g�������Ṥҵ������Ҫ��Ӧ����÷�Ӧ��ʹ�ô�����������Ϊ�Ӵ��������ᡣ
��1��ʹ��V2O5���÷�Ӧʱ���漰������V2O5���Ȼ�ѧ��Ӧ�У�
��V2O5��s����SO2��g��![]() V2O4��s����SO3��g�� ��H1����59.6kJ��mol-1
V2O4��s����SO3��g�� ��H1����59.6kJ��mol-1
��2V2O4��s����O2��g��![]() 2V2O5��s�� ��H2����315.4kJ��mol��1
2V2O5��s�� ��H2����315.4kJ��mol��1
��2SO2��g����O2��g��![]() 2SO3��g�� ��H3��__________kJ��mol-1
2SO3��g�� ��H3��__________kJ��mol-1
��2����10 L�ܱ������м���V2O4��s����SO2��g����1 mol��һ������O2���ı����O2�������ڳ����·�Ӧһ��ʱ����������V2O4��V2O5��SO2��SO3�����淴Ӧǰ����O2�ı仯��ͼ����ʾ��ͼ��û������SO3�Ŀ���ԭ����_________________________
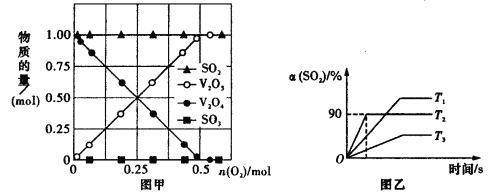
��3����ԭ10 L�ĺ���װ���У�����V2O5��s����SO2��g����0��6 mol��O2��g��0��3 mol���ֱ���T1��T2��T3ʱ���з�Ӧ�����������SO2��ת������ͼ����ʾ��
��T2ʱ��2SO2��g����O2��g��![]() 2SO3��g����ƽ�ⳣ��K��__________��
2SO3��g����ƽ�ⳣ��K��__________��
�ڽ�ϻ�ѧ����ʽ��������֣����ͷ�ӦΪʲô��T3�����±�T2�����µ���������_____
��4�����¶�T2ʹ��V2O5���з�Ӧ��2SO2��g����O2��g��![]() 2SO3��g�����ڱ�֤O2��g����Ũ�Ȳ���������£����������������ƽ��__________������ĸ���ţ���
2SO3��g�����ڱ�֤O2��g����Ũ�Ȳ���������£����������������ƽ��__________������ĸ���ţ���
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ�
C�����ƶ� D����ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com