分析:(1)从图示可知氯化时的反应物为FeTiO
3、C、Cl
2,生成物为FeCl
3、TiCl
4、CO,再根据得失电子和原子守恒即可得出该反应的方程式分析计算判断;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①依据化学平衡三段式列式,计算消耗浓度、平衡浓度,结合反应速率=
,平衡常数等于生成物平衡浓度幂次方乘积除以反应物幂次方乘积得到;
②依据化学反应特征和图象分析方法,结合平衡移动原理分析,先拐先平,温度、压强大分析,催化剂改变反应速率,不改变化学平衡;
(4)①电解饱和食盐水,阳极生成氯气,阴极生成氢气,溶液中形成氢氧化钠;
②阳极是溶液中氯离子失电子生成氯气,氯气和水反应生成盐酸和次氯酸,存在化学平衡,加入盐酸,平衡逆向进行.
解答:
解:(1)从图示可知氯化时的反应物为FeTiO
3、C、Cl
2,生成物为FeCl
3、TiCl
4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为:2FeTiO
3+6C+7Cl
22TiCl
4+2FeCl
3+6CO,钛铁矿经氯化法得到四氯化钛的过程中Ti、C元素化合价升高失电子做还原剂被氧化,每生产1.9kgTiCl
4,物质的量=
=10mol,消耗氯气物质的量=
=35mol,消耗Cl
2在标准状况下的体积=35mol×22.4L/mol=784L,
故答案为:Ti、C;784;
(2)①Mg(s)+Cl
2(g)═MgCl
2(s)△H=-641kJ?mol
-1②Ti(s)+2Cl
2(g)═TiCl
4(g)△H=-804kJ?mol
-1依据盖斯定律计算,①×2-②得到金属Mg还原TiCl
4制取金属Ti(s)的热化学方程式为:2Mg(s)+TiCl
4(g)=2MgCl
2(s)+Ti(s)△H=-478KJ/mol;
故答案为:2Mg(s)+TiCl
4(g)=2MgCl
2(s)+Ti(s)△H=-478KJ/mol;
(3)①在300℃时,向体积为1L的密闭容器中加入2mol H
2和1mol CO,CO和CH
3OH(g)的浓度随时间变化如图2所示.则从反应开始到建立平衡,平衡浓度c(CH
3OH)=0.75mol/L,c(CO)=0.25mol/L,达到平衡时间为10min,则
CO(g)+2H
2(g)?CH
3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.75 1.5 0.75
平衡量(mol/L) 0.25 0.5 0.75
v(H
2)=
=0.15mol/L?min;
平衡常数K=
=12
故答案为:0.15mol/L?min;12;
②CO(g)+2H
2(g)
CH
3OH(g)△H=-91kJ?mol
-1,反应是放热反应,
A、图象中先拐先平,温度高,温度越高,平衡逆向进行,甲醇物质的量减小,故A符合;
B、图象中先拐先平,压强大,反应是气体体积减小的反应,压强增大平衡正向进行,甲醇物质的量增大,故B不符合;
C、依据平衡移动原理可知温度越高,平衡逆向进行,甲醇物质的量减小,图象不符合,故C不符合;
D、加入催化剂加快反应速率,缩短达到平衡的时间,最后达到平衡状态相同,故D符合;
故答案为:AD;
(4)①电解食盐水生成NaOH、H
2和Cl
2,反应的离子方程式为2Cl
-+2H
2O
2OH
-+H
2↑+Cl
2↑,故答案为:2Cl
-+2H
2O
2OH
-+H
2↑+Cl
2↑;
②阳极是溶液中氯离子失电子生成氯气,氯气和水反应生成盐酸和次氯酸,存在化学平衡,Cl
2+H
2O?H
++Cl
-+HClO,加入盐酸,平衡逆向进行,减少氯气在水中的溶解,有利于氯气逸出;
故答案为:氯气和水反应,Cl
2+H
2O=H
++Cl
-+HClO,增大H
+浓度使平衡逆向进行,减少氯气在水中的溶解,有利于氯气逸出.





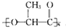 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )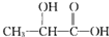
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式

 如图所示为NaCl晶体的晶胞示意图.
如图所示为NaCl晶体的晶胞示意图.