
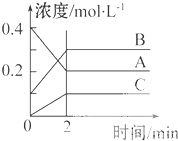
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A、发生的反应可表示为:2A(g)?2B(g)+C(g) |
| B、前2 min A的分解速率为0.1mol?L-1?min-1 |
| C、开始时,正逆反应同时开始 |
| D、2 min时,A、B、C的浓度之比为2:3:1 |
| △c |
| △t |
| 0.2mol/L |
| 2min |


科目:高中化学 来源: 题型:
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
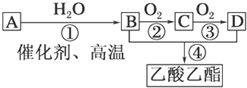 根据所给信息填空
根据所给信息填空| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
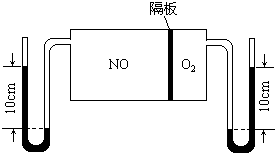
查看答案和解析>>
科目:高中化学 来源: 题型:
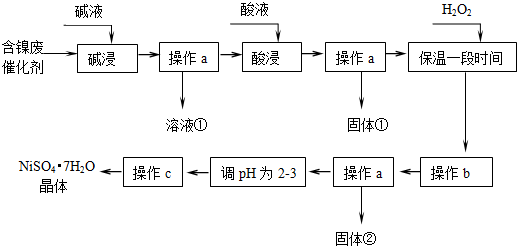
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
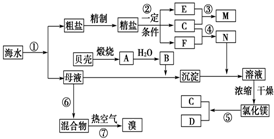
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、在常温常压下,11.2 L Cl2含有的分子数约为0.5 NA |
| C、25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com