
【题目】砷(As)与氮、磷同一主族,可以形成As4、As2S3、As2O5、H3AsO3、H3AsO4等物质,有着广泛的用途。回答下列问题:
(1)As原子最外层电子的电子云伸展方向有___种。黄砷(As4)与白磷(P4)的结构类似,以下关于黄砷与白磷的比较叙述正确的是___(填编号)。
A.黄砷的熔点高于白磷 B.黄砷中共价键键能大于白磷
C.黄砷分子极性大于白磷 D.分子中共价键键角均为109°28′
(2)As元素的非金属性比N弱,用原子结构的知识说明理由。___。
(3)298K时,将20mL3xmol/LNa3AsO3、20mL3xmol/LI2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
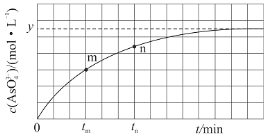
①若平衡时,pH=14,该反应的平衡常数为___。
②当反应达到平衡时,下列选项正确的是__(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=ymol/L
不再变化 d.c(I-)=ymol/L
③tm时,v正__v逆(填“大于”“小于”或“等于”)。
④tm时,v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
【答案】4 A As电子层数比N多,原子半径大,质子对核外电子的吸引力弱,非金属性弱 ![]() (mol·L-1)-1 ac 大于 小于 tm时生成物浓度较低
(mol·L-1)-1 ac 大于 小于 tm时生成物浓度较低
【解析】
As和P位于相同主族,原子半径As>P,由同主族元素从上到下非金属性逐渐减弱可知非金属性P>As,形成的晶体都为分子晶体,相对分子质量越大,分子间作用力越强,以此分析解答(1)和(2);
(3)①首先计算反应前,混合溶液中反应物的浓度,根据图像,反应达到平衡时,c(AsO43-)为ymol/L,再根据反应的方程式计算平衡时各物质的浓度,最后计算平衡常数;②a.溶液pH不变时,则c(OH-)也保持不变;b.同一个化学反应,速率之比等于化学计量数之比;c.![]() 不再变化,可说明各物质的浓度不再变化;d.c (AsO43-)=y molL-1时为平衡状态,据此分析判断;③反应从正反应开始进行,tm时反应未达到平衡状态;④tm时比tn时AsO43-浓度更小。
不再变化,可说明各物质的浓度不再变化;d.c (AsO43-)=y molL-1时为平衡状态,据此分析判断;③反应从正反应开始进行,tm时反应未达到平衡状态;④tm时比tn时AsO43-浓度更小。
(1)As为33号元素,原子最外层电子的排布为4s24p3,其中4p有3种电子云伸展方向,因此电子云伸展方向共有4种;A.黄砷(As4)与白磷(P4)形成的晶体都为分子晶体,相对分子质量越大,分子间作用力越强,则熔点越高,黄砷的熔点高于白磷,故A正确;B.原子半径As>P,键长越大,键能越小,黄砷中共价键键能小于白磷,故B错误;C.黄砷(As4)与白磷(P4)都为非极性分子,分子极性相同,故C错误;D.黄砷(As4)与白磷(P4)都是正四面体结构,分子中共价键键角均为60°,故D错误;故选A,故答案为:4;A;
(2)As电子层数比N多,原子半径大,质子对核外电子的吸引力弱,非金属性弱,因此As元素的非金属性比N弱,故答案为:As电子层数比N多,原子半径大,质子对核外电子的吸引力弱,非金属性弱;
(3)①反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L×![]() =xmol/L,同理I2的浓度为xmol/L,根据图像,反应达到平衡时,c(AsO43-)为ymol/L,则反应生成的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,pH=14,溶液中c(OH-)=1mol/L,则K=
=xmol/L,同理I2的浓度为xmol/L,根据图像,反应达到平衡时,c(AsO43-)为ymol/L,则反应生成的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,pH=14,溶液中c(OH-)=1mol/L,则K=![]() =
=![]() (mol·L-1)-1,故答案为:
(mol·L-1)-1,故答案为:![]() (mol·L-1)-1;
(mol·L-1)-1;
②a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;c.![]() 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;d.由图可知,当c (AsO43-)=y molL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y molL-1,所以c(I-)=y molL-1时没有达到平衡状态,故d错误;故答案为:ac;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;d.由图可知,当c (AsO43-)=y molL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y molL-1,所以c(I-)=y molL-1时没有达到平衡状态,故d错误;故答案为:ac;
③反应从正反应开始进行,tm时反应未达到平衡状态,反应继续正向进行,则v正 大于 v逆,故答案为:大于;
④tm时比tn时AsO43-浓度更小,反应速率更慢,则逆反应速率更小,tm时v逆 小于tn时v逆,故答案为:小于;tm时生成物浓度较低。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)原子数相同,价电子数也相同的微粒,称为等电子体。等电子体具有相似的化学键特征,性质相似。CO的结构式为_______________。
(2)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______ 。
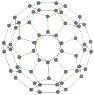
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(![]() )的结构如图,分子中碳原子轨道的杂化类型为______;1 mol
)的结构如图,分子中碳原子轨道的杂化类型为______;1 mol ![]() 分子中
分子中![]() 键的数目为______ 。
键的数目为______ 。
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As_____Se(填“>”、“<”或“=”)。
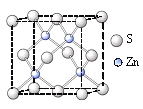
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是_______。
③二氧化硒分子的空间构型为________。
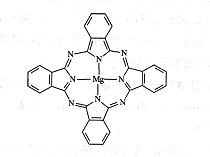
(5)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.含有相同铜原子数的Cu2S和CuO的质量相等B.2g氢气所含质子数目为NA
C.lmol氨气含有的原子数目为2NAD.22.4LCH4所含电子数目为l0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I是一种医药合成中间体,实验室以芳香烃A为原料制备I的路线如下(部分反应条件已省略):
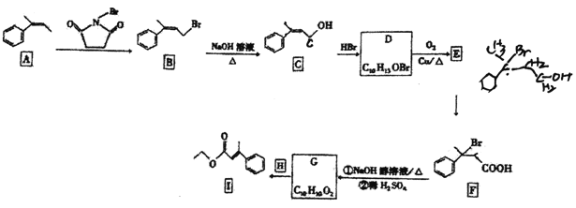
已知:RCH=CH2+HBr![]() RCH2CH2Br。回答下列问题:
RCH2CH2Br。回答下列问题:
(1)X的分子式为C8H8,且X与A互为同系物,则X的化学名称是 ______。
(2)B生成C的反应类型是_____, B、C含有的相同的官能团名称是 _____。
(3)碳原子上连有4个不同原子或基团时,该碳原子为手性碳原子。写出D的结构简式,并用星号![]() 标出其中的手性碳原子_____。
标出其中的手性碳原子_____。
(4)写出D—E 的化学反应方程式:_________。
(5)G的结构简式是 ______。
(6)Y与C是同分异构体,Y中含苯环,且苯环上有2个取代基,Y能发生银镜反应,其核磁共振氢谱中有5组峰,且峰面积之比为6:2:2:1:1,则Y的结构简式为 _______。
(7)丙二酸(HOOCCH2COOH)主要用作医药合成中间体、电镀抛光剂等。结合题目信息,设计以丙烯(CH3CH=CH2) 和![]() 为原料制备丙二酸的合成路线______(无机试剂任选)。
为原料制备丙二酸的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
现有下列七种物质:①液态氯化氢;②小苏打;③纯碱粉末;④葡萄糖;⑤氢氧化钾;⑥氢氧化铁胶体;⑦硫酸铁溶液;
(1)上述七种物质中,属于电解质的有_______,属于非电解质的有____。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________。
(3)除去③中少量②的方法是_______,化学方程式为________________。
(4)现有100mL⑦溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是______。
(5)若在⑥中缓慢加入①的水溶液,产生的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动检验管道焊缝设备爬行器的甲醇-燃料电池的工作原理示意如图,下列有关该电池说法正确的是
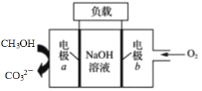
A.该电池工作时,每消耗22.4 L CH3OH转移6 mol电子
B.电子由电极a经负载流向电极b,再经过氢氧化钠溶液返回电极a,形成闭合回路
C.电池工作时,OH-向电极a移动,溶液的pH减小
D.电极b上发生的电极反应为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )

A.D、E中一定都含有甲元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com